
- •Гетерогенные равновесия с участием малорастворимых соединений
- •1. Основные законы и количественные характеристики, используемые при расчете равновесий в растворах малорастворимых соединений
- •Задачи для самостоятельного решения
- •2. Расчет растворимости мрс в присутствии индифферентных ионов
- •Задачи для самостоятельного решения
- •3. Расчет растворимости мрс в присутствии одноименных ионов
- •Задачи для самостоятельного решения
- •4.1 Расчет растворимости мрс, образованного анионом слабой кислоты
- •4.2 Расчет растворимости мрс, образованного катионом слабого основания
- •4.3 Расчет растворимости мрс, образованного анионом слабой кислоты и катионом слабого основания
- •Задачи для самостоятельного решения
- •5. Расчет растворимости мрс с учетом влияния процесса комплексообразования
- •Задачи для самостоятельного решения
- •6. Расчет растворимости мрс с учетом влияния рН раствора
- •Задачи для самостоятельного решения
- •7. Расчет растворимости мрс с учетом одновременного влияния различных факторов
- •Задачи для самостоятельного решения
- •Литература
- •Приложение Произведение активности некоторых малорастворимых электролитов в воде
- •Содержание
Задачи для самостоятельного решения
Рассчитайте растворимость осадка AgI в его насыщенном растворе, содержащем 0,1 моль/л аммиака.
Вычислите начальную концентрацию аммиака в моль/л раствора, 5 мл которого достаточно для полного растворения 10 мг хлорида серебра.
Рассчитайте растворимость иодида серебра в 0,01 М растворе цианида калия.
Вычислите растворимость роданида серебра в 0,01 М растворе аммиака.
Рассчитайте растворимость иодида свинца в 0.01 М растворе Na2S2O3.
Вычислите растворимость осадка AgBr в его насыщенном растворе, содержащем 0,1 моль/л NaBr.
Растворится ли 0,2 г бромида серебра в 100 мл 1 М раствора аммиака?
Рассчитайте растворимость карбоната цинка в 0,8 М растворе NH3.
Выпадет ли осадок сульфида кадмия, если через раствор, содержащий 10-3 М кадмия и 1 М соляной кислоты, пропустить до насыщения сероводород (С(Н2S) = 0,1 М)?
При какой концентрации ионов S2- начнется выпадение осадка CdS из 0,05 М раствора K2[Cd(CN)4], содержащего 0,1 моль KCN в 1 л раствора?
6. Расчет растворимости мрс с учетом влияния рН раствора
Среди условий, влияющих на растворимость осадков, важное значение имеет рН раствора. В кислой или щелочной средах, растворимость осадков, как правило, повышается. Это объясняется: 1) образованием слабых кислот в кислой среде, 2) протеканием гидролиза в нейтральной среде, 3) образованием гидроксокомлексов в щелочной среде; и кроме того, увеличением ионной силы раствора (солевым эффектом). Протекание таких процессов приводит к связыванию аниона либо катиона и смещению гетерогенного равновесия в сторону растворения осадка.
а) Влияние кислой среды на растворимость МРС
В кислой среде происходит растворение малорастворимых солей, которые образованы анионом слабых кислот.
Равновесия в насыщенном растворе МРС состава МmАn при добавлении кислоты НА имеют вид:
![]()
![]()
![]()
………………… …………………
![]()
Суммарная реакция:
![]() (6.1)
(6.1)
Обозначим: S – растворимость осадка, тогда mS и nS – концентрации катиона и аниона, обусловленные растворимостью осадка MmAn.
Согласно уравнению материального баланса растворимость осадка можно определить по аниону как сумму равновесных концентраций всех форм аниона:
![]() (6.2)
(6.2)
и по катиону:
![]() (6.3)
(6.3)
Подставим выраженные через константы диссоциации равновесные концентрации анионов в уравнение (6.2):
![]() (6.4)
(6.4)
Равновесную концентрацию ионов выразим через произведение растворимости: и с учетом уравнения (6.3), получаем:
![]() ,
откуда:
,
откуда: ![]() .
.
Подставляем полученное выражение в формулу (6.4):

Выражаем растворимость:
 (6.5)
(6.5)
где .
Для бинарного осадка МА при m = n = 1 уравнение (6.5) принимает более простой вид

и растворимость осадка рассчитывают по формуле:
 (6.6)
(6.6)
Уточним:
если осадок образован однозарядными катионом и анионом, то в кислой среде образуется слабая одноосновная кислота и растворимость МРС состава МА рассчитывается по формуле:
 ,
(6.7)
,
(6.7)
если осадок образован двухзарядными катионом и анионом, то в кислой среде образуется слабая двухосновная кислота и растворимость МРС состава МА рассчитывается по формуле:
 .
(6.8)
.
(6.8)
Следует отметить, что большинство МРС образованы анионами слабых двухосновных кислот (например, CaC2O4, ZnCO3, CdS и др.), растворимость таких осадков рассчитывается по формуле (6.8).
Для осадка состава М2А при m =2, n = 1 (например, Ag2S, Ag2CO3) уравнение (6.5) принимает следующий вид:

и растворимость таких осадков рассчитывают по формуле:
 (6.9)
(6.9)
Для осадка состава М3А при m =3, n = 1 (например, Ag3PO4, Ag3AsO4) уравнение (6.5) принимает следующий вид:

и растворимость таких осадков рассчитывают по формуле:
 (6.10)
(6.10)
Таким образом, из выражений (6.6)-(6.10) видно, что растворимость МРС зависит от кислотности раствора, константы диссоциации кислоты и произведения растворимости осадка. Чем больше рН раствора и чем меньше константа диссоциации кислоты (чем слабее кислота), тем сильнее анион связывается с Н+ и растворимость осадка повышается. При этом необходимо учитывать соотношение величин KS и Kd: если величина KS сопоставима или не намного меньше Kd, то влияние рН раствора существенно и осадки хорошо растворяются в кислой среде (например, оксалаты, карбонаты и др.); если KS намного меньше Kd, то влияние рН раствора незначительно и растворимость осадка очень мала даже в сильнокислых растворах (например, сульфиды).
Пример 1.
Рассчитайте растворимость оксалата
кальция в растворе сильной кислоты НА
с концентрацией: а) 10-4
моль/л, б) 10-3
моль/л, в) 10-2
моль/л, г)
10-1
моль/л.
(СаС2О4)
= 2,3.10-9.
![]() (Н2С2О4)
= 5,6.10-2,
(Н2С2О4)
= 5,4.10-5.
(Н2С2О4)
= 5,6.10-2,
(Н2С2О4)
= 5,4.10-5.
Решение:
Равновесие в насыщенном растворе оксалата кальция выражается уравнением:
СaС2O4(тв) ↔ Сa2+ + С2O42-
В кислой среде протекает реакция взаимодействия оксалат-ионов с Н+ и равновесие осадок-раствор смещается вправо:
С2O42- + Н+ ↔ НС2О4-
а при дальнейшем увеличении кислотности в растворе появятся молекулы щавелевой кислоты:
НС2O4- + Н+ ↔ Н2С2О4
В результате этих
процессов равновесная концентрация
![]() -
ионов уменьшится и в соответствии с
правилом произведения растворимости
из осадка в раствор должны поступить
новые количества оксалата кальция.
-
ионов уменьшится и в соответствии с
правилом произведения растворимости
из осадка в раствор должны поступить
новые количества оксалата кальция.
Таким образом, растворение оксалата кальция под действием сильной кислоты можно представить обобщенным уравнением:
СaС2O4 (тв) + 2Н+ ↔ Сa2+ + Н2С2О4
Осадок СaС2O4 образован двухзарядными катионом и анионом и имеет состава тип МА. Растворимость в насыщенном растворе таких солей рассчитывается по формуле (6.8):
Для условия а) С (Н+) = 10-4 моль/л
![]() = 0,954;
= 0,954;
![]() =
0,954.
=
0,954.
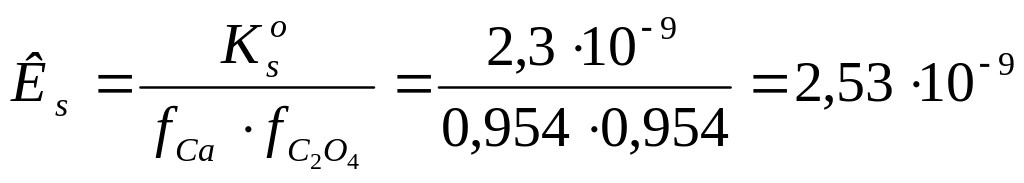
 моль/л
моль/л
Рассчитанные значения растворимости СaС2O4 в растворе сильной кислоте для условий а) - г) представлены в таблице.
![]() моль/л.
моль/л.
-
СН+, моль/л
Коэфф-ты активности
Произве-
дение раствор-ти Кs
Раст-сть (S) СaС2O4,
моль/л
S/S0
а) 10-4
0,954
0,954
2,53.10-9
8,499.10-5
1,77
б) 10-3
0,870
0,870
3,04.10-9
2,456.10-4
5,12
в) 10-2
0,675
0,675
5,05.10-9
1,052.10-3
21,93
г) 10-1
0,405
0,405
14,02.10-9
8,505.10-3
177,34
Сравнение растворимости насыщенного раствора СaС2O4 в зависимости от концентрации сильной кислоты НА представлено на рис. 6.1.

Рис. 6.1. Зависимость растворимости насыщенного раствора СaС2O4 от концентрации сильной кислоты НА.
Видно, что с увеличением кислотности раствора растворимость оксалата кальция существенно возрастает.
Пример 2. Рассчитайте и сравните растворимость оксалата кальция, карбоната кальция и сульфида кадмия в растворе с рН: а) 3, б) 2, в) 1. (СаС2О4) = 2,3.10-9. (Н2С2О4) = 5,6.10-2, (Н2С2О4) = 5,4.10-5.
(СаСО3) = 4,8.10-9. (Н2СО3) = 4,5.10-7, (Н2СО3) = 4,8.10-11.
(СdS) = 7,9.10-27. (Н2S) = 8,9.10-8, (Н2S) = 1,3.10-13.
Решение:
Пример 2 аналогичен примеру 1. Рассчитанные значения растворимостей осадков в кислой среде для условий а) - в) представлены в таблицах.
СаС2О4
моль/л
-
СН+, моль/л
Коэфф-ты активности
Произве-
дение раствор-ти Кs
Раст-сть (S) СaС2O4,
моль/л
S/S0
а) 10-3
0,870
0,870
3,04.10-9
2,456.10-4
5,12
б) 10-2
0,675
0,675
5,05.10-9
1,052.10-3
21,93
в) 10-1
0,405
0,405
14,02.10-9
8,505.10-3
177,34
CaCO3
![]() моль/л
моль/л
-
СН+, моль/л
Коэфф-ты активности
Произве-
дение раствор-ти Кs
Раст-сть (S) CaCO3,
моль/л
S/S0

а) 10-3
0,870
0,868
6,36.10-9
17,16
2,5.105
б) 10-2
0,675
0,665
10,69.10-9
222,5
3,2.106
в) 10-1
0,405
0,370
32,03.10-9
3851
5,6.107
При добавлении к насыщенному раствору CaCO3 кислоты осадок полностью растворяется.
CdS
![]() моль/л
моль/л
-
СН+, моль/л
Коэфф-ты активности
Произве-
дение раствор-ти Кs
Раст-сть (S) CdS,
моль/л
S/S0


а) 10-3
0,868
0,868
10,48.10-27
9,518.10-7
1,07.107
б) 10-2
0,670
0,670
17,60.10-27
1,233.10-5
1,39.108
в) 10-1
0,380
0,380
54,71.10-27
2,174.10-4
2,45.109
Таблица сравнения:
СН+, моль/л |
Раст-сть (S) СaС2O4, моль/л |
S/S0 для СaС2O4 |
Раст-сть (S) СaСO3, моль/л |
S/S0 для СaСO3 |
Раст-сть (S) СdS, моль/л |
S/S0 для СdS |
а) 10-3 |
2,456.10-4 |
5,12 |
17,16 |
2,5.105 |
9,518.10-7 |
1,07.107 |
б) 10-2 |
1,052.10-3 |
21,93 |
222,5 |
3,2.106 |
1,233.10-5 |
1,39.108 |
в) 10-1 |
8,505.10-3 |
177,3 |
3851 |
5,6.107 |
2,174.10-4 |
2,45.109 |
Сравнивая зависимости растворимости различных МРС от кислотности среды, можно сделать следующие выводы:
Для МРС СаС2О4 и СаСО3 произведения растворимостей имеют одинаковый порядок 10-9, но
 (Н2СО3)«
(Н2С2О4)
– на 5 порядков, в результате растворимость
СаСО3
оказалась на 5 порядков больше в кислой
среде, чем таковая у СаС2О4.
Причем осадок СаСО3
растворяется полностью уже при рН=3.
(Н2СО3)«
(Н2С2О4)
– на 5 порядков, в результате растворимость
СаСО3
оказалась на 5 порядков больше в кислой
среде, чем таковая у СаС2О4.
Причем осадок СаСО3
растворяется полностью уже при рН=3.Для МРС CdS и СаСО3 значения сопоставимы, но (СdS)« (СаСО3) – на 18 порядков, в результате растворимость СаСО3 оказалась на 9 порядков больше растворимости CdS.
Анализ результатов относительной растворимости (S/S0) показывает, что растворимость возрастает в ряду СаС2О4 « СаСО3 « CdS, при этом абсолютное значение растворимости в кислой среде увеличивается в ряду CdS « СаС2О4 « СаСО3.
б) Растворимость МРС в нейтральной среде
Если МРС образовано слабым основанием и слабой кислотой, то в насыщенном (но при этом очень разбавленном) растворе такой соли протекает гидролиз по катиону и по аниону. Следует отметить, что влияние гидролиза на растворимость проявляется сильно в том случае, если вследствие малой растворимости ( ) растворенная соль не влияет на рН раствора, т.е. остается практически равным 7. Гидролиз многократно увеличивает растворимость соли, например, растворимость СdS увеличивается за счет гидролиза по катиону и по аниону в 1300 раз.
Расчет растворимости таких МРС в нейтральной среде – см. раздел 4.3.
в) Влияние щелочной среды на растворимость МРС
В щелочной среде катионы МРС могут образовывать гидроксокомплексы, что приведет к повышению растворимости осадка.
Расчет растворимости таких соединений в щелочной среде с учетом влияния процесса комплексообразования – см. раздел 5.
