
- •Периодическое изменение свойств химических элементов Электронная конфигурация атома элемента определяет свойства этого элемента в Периодической системе.
- •Электролитическая диссоциация кислот, солей, оснований
- •[Править]Окисление
- •[Править]Восстановление
- •[Править]Окислительно-восстановительная пара
- •[Править]Виды окислительно-восстановительных реакций
- •[Править]Примеры [править]Окислительно-восстановительная реакция между водородом и фтором
- •[Править]Окисление, восстановление
- •[Править]Формулировка законов
- •Выход по току
[Править]Формулировка законов
В учебниках и научной литературе можно найти несколько версий формулировки законов. В наиболее общем виде законы формулируются следующим образом:
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Выход по току
[править]
Материал из Википедии — свободной энциклопедии
Выходом по току в гальванотехнике называют выраженное в процентах отношение количества фактически пропущенного через электролит заряда (Qf) к теоретически необходимому (Qt) для осуществления фактически наблюдаемого массопереноса (mf).
![]()
Иногда выход по току рассчитывается как отношение массы при фактическом массопереносе mf к теоретическому массопереносу mt, рассчитанному по закону Фарадея:
![]()
Для случая осаждения массы на электроде выход по току оказывается всегда выше 1. Для случая растворения материала электрода выход по току оказывается всегда ниже 1.
Выход по току связан с электрохимическим эквивалентом.
Электрохимическим эквивалентом в гальванотехнике называют количество вещества, выделившееся или растворившееся на электроде, отнесённое к величинезаряда, пропущенного через электролит:
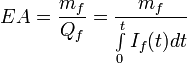 ,
,
где
mf - масса фактически осаждённого или растворённого материала электрода;
Qf - фактически пропущенный заряд, определяемый как интеграл пропускаемого через электролит тока по времени.
практическое применение электролиза
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений, диоксида марганца, пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование). Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
