
- •Периодическое изменение свойств химических элементов Электронная конфигурация атома элемента определяет свойства этого элемента в Периодической системе.
- •Электролитическая диссоциация кислот, солей, оснований
- •[Править]Окисление
- •[Править]Восстановление
- •[Править]Окислительно-восстановительная пара
- •[Править]Виды окислительно-восстановительных реакций
- •[Править]Примеры [править]Окислительно-восстановительная реакция между водородом и фтором
- •[Править]Окисление, восстановление
- •[Править]Формулировка законов
- •Выход по току
Строение втома и периодическая система.
Строение ядра атома- протоны и нейтроны являются частичками ядра.
Современная квантово-механическ модель строения атома - Современная - квантово-механическая модель, на основе квантовой механики (электроны находятся в пространстве около ядра в разных его точках с разной вероятностью, но не имеют определенных орбит).
Квантовые числа- численное значение какой-либо квантованной переменной микроскопического объекта (элементарной частицы, ядра, атома и т. д.), характеризующее состояние частицы. Задание квантовых чисел полностью характеризует состояние частицы.
Принцип наименования энергии- В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром)
При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии.
Правило
Клечковского (также Правило
n+l;
также используется название правило
Маделунга) —
эмпирическое правило, описывающее
энергетическое распределение орбиталей в
многоэлектронных атомах.
-
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спиновогоквантового числа электронов данного подслоя должен быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Связь между положением химического элемента и электронным строением его атома, Химическая связь — явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.
Периодическое изменение свойств химических элементов Электронная конфигурация атома элемента определяет свойства этого элемента в Периодической системе.
Число энергетических уровней атома данного элемента равно номеру периода, а число валентных электронов - номеру группы, к которым относится данный элемент.
Эле́ктроотрица́тельность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары.
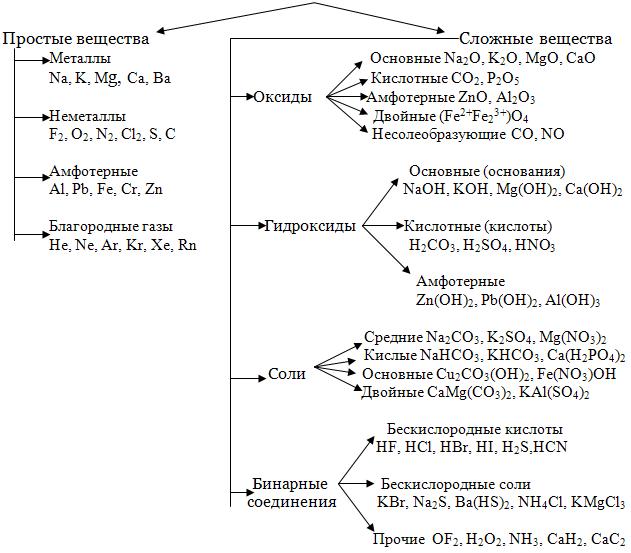
Классы неорганических соединений.
Основные Классы неорганических соединений.
1.http://school-sector.relarn.ru/nsm/chemistry/Rus/Data/Text/Ch1_7-1.html
2. http://www.upravlenie.edu.kg/uchitelyu/khimii/13-khimiya-8-11-klassy « контр +F» и ищите что нужно.
- описано подробно.
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
Правило образований и т.д. - http://zaykan.narod.ru/teor/him/nomenkl_inorg.pdf. Тут все про неорганическую хрень.
Равновесия в растворах электролитов.
Электролитическая диссоциация кислот, солей, оснований
Электролитическая диссоциация — распад электролитов на ионы при растворении в воде или расплавлении. Этот процесс изображают с помощью уравнений диссоциации:
NaCl = Na+ + Cl−
HCl = H+ + Cl−
Na2SO4 = 2Na+ + SO42−
Если через раствор или расплав электролита пропускать электрический ток, то положительные ионы будут двигаться к отрицательному электроду — катоду. Положительные ионы получили название катионы.
Отрицательные ионы будут двигаться к положительному электроду — аноду, и называются анионами.
Следовательно, при диссоциации солей образуются катионы металла и анионы кислотного остатка (в состав солей могут входить и другие ионы). При диссоциации кислот образуются в качестве катионов ионы водорода, и анионы кислотных остатков.
Механизм диссоциации электролитов при растворении в воде:
Многие соли — вещества с ионной связью, состоят из положительных и отрицательных ионов, связанных за счет притягивания противоположных зарядов. При растворении в воде происходит гидратация ионов — взаимодействие ионов с полярными молекулами воды. Это уменьшает притяжение между ионами соли и делает возможным переход гидратированных, т.е. связанных с молекулами воды, ионов в раствор (этому способствует тепловое движение частиц).
При выпаривании соли из раствора часть воды может оставаться в составе получаемых кристаллов — кристаллизационная вода. Например, сульфат меди (II) при выпаривании из раствора образует медный купорос (синего цвета), содержащий 5 моль воды на 1 моль соли. Формула медного купороса записывается как CuSO4•5H2O — точка обозначает связь между молекулами воды и ионами в составе сульфата меди(II).
При длительном нагревании медного купороса кристаллизационная вода улетучивается и соль приобретает белый цвет. Синий цвет растворов, содержащих ионы меди (II), свидетельствует о том, что в растворе находятся гидратированные ионы.
У оснований механизм диссоциации такой же, как и у солей. Растворимые основания — щелочи, — диссоциируют с образованием катиона металла и гидроксид-ионов:
NaOH = Na+ + OH–
Кислоты содержат ковалентные полярные связи. Так, молекула хлороводорода поляризована:
Hδ+Clδ−
(δ+ и δ− означают частичные заряды, меньше единицы). При растворении в воде в результате гидратации поляризация молекулы усиливается и происходит разрыв связи между водородом и кислотным остатком с образованием положительного иона водорода и отрицательного иона кислотного остатка.
Ионом водорода называют именно гидратированный протон и обозначают H3O+, но для простоты записывают H+
Согласно экспериментальным данным, в растворах не обнаружены частицы H3O+. Анализ показывает наличие катионов, включающих две молекулы воды: H5O2+
Основатель теории диссоциации электролитов в растворах — шведский ученый Сванте Аррениус. Гидратная теория растворов разработана Д.И.Менделеевым
При расплавлении электролитов разрыв связей с образованием ионов происходит за счет увеличения энергии частиц при нагревании.
необходимыми условиями протекания реакций ионного обмена до конца являются: 1) образование осадка; 2) выделение газа; 3) образование малодиссоциирующих молекул воды.
Способы выражения состава растворов.
Массовая доля.

Мольная доля.

Молярная
концентрация .
Молярная концентрация эквивалента.

Моляльная концентрация –

. Окислительное - восстановительная реакция
Понятие: Окислительное - восстановительная реакция., востанов., степень окисления,…
Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельныехимические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то естьвосстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
