
- •Вопросы к экзамену по химии 2 курс.
- •Растворы. Способы выражения концентраций растворов (молярная, моляльная, массовая доля, мольная доля, молярная концентрация эквивалента).
- •Диссоциация комплексных ионов. Константа нестойкости.
- •Осмос. Осмотическое давление растворов, закон Вант-Гоффа.
- •Закон Вант-Гоффа:
- •Электродные потенциалы.
- •Понятие о межфазной энергии и поверхностно-активных веществах.
- •Сильные и слабые электролиты. Степень диссоциации.
- •Слабыми электролитами являются:
- •Шкала электродных потенциалов. Водородный электрод.
- •Комплексные соединения. Их структура.
- •Труднорастворимые электролиты. Произведение растворимости.
- •Электродные реакции. Расчет э.Д.С. Гальванического элемента.
- •Растворимость. Условия образования осадка. Условия растворения осадка.
- •Адсорбция. Поверхностные явления. Поверхностный слой.
- •Электролитическая диссоциация воды. Водородный показатель.
- •Структура комплексных соединений. Ступенчатое комплексообразование.
- •Гидролиз солей.
- •Поверхностные явления. Адсорбция.
- •Адсорбция на границе раствор-пар.
- •Адсорбция на границе твёрдое тело – газ
- •Адсорбция на границе твёрдое тело - раствор.
- •Степень гидролиза. Константа гидролиза.
- •Разрушение комплексных ионов. Константа нестойкости.
- •Факторы, влияющие на степень протекания гидролиза. Необратимый гидролиз.
- •Стандартные окислительно-восстановительные потенциалы.
- •Направление реакций обмена в растворах электролитов. Примеры.
- •Водородный показатель. Методы определения рН растворов.
- •Определение направления реакций окисления-восстановления.
- •Спектральные методы анализа.
- •Потенциометрическое титрование.
- •Методы определения рН.
- •Карбоновые кислоты
- •Электрохимические методы анализа.
- •Систематический качественный анализ
- •Альдегиды и кетоны
Комплексные соединения. Их структура.
Комплексные соединения – это определённые химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию как в кристаллическом, так ив растворённом состоянии.
В молекуле комплексного соединения один из атомов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем, или центральным атомом. В непосредственной близости к нему расположены (координированы) противоположно заряженные ионы или нейтральные молекулы, называемые лигандами. Комплексообразователь и лиганды составляют внутреннюю сферу комплексного соединения. Общее число σ-связей, образуемых комплексообразователем с лигандами, называется координационным числом центрального иона. По числу σ-связей, образуемых лигандом с комплексообразователем, лиганды делятся на моно-, ди- и более дентатные лиганды.
За пределами внутренней сферы комплексного соединения находится его внешняя сфера, содержащая положительно заряженные ионы (если внутренняя сфера комплексного соединения заряжена отрицательно) или отрицательно заряженные ионы (если наоборот); в случае незаряженной внутренней сферы внешняя сфера отсутствует.
Ионы, находящиеся во внешней сфере, связаны с комплексным ионом силами электростатического взаимодействия и в растворах легко отщепляются подобно ионам сильных электролитов. Лиганды, находящиеся во внутренней сфере комплекса, связаны с комплексообразователем ковалентными связями, и их диссоциация в растворе осуществляется в незначительной степени. С помощью качественных реакций обнаруживаются только ионы внешней сферы.
Ступенчатая диссоциация многоосновных кислот и многокислотных оснований.
В растворах многоосновных кислот, а также оснований, содержащих несколько гидроксильных групп, устанавливаются ступенчатые равновесия, отвечающие последовательным стадиям диссоциации.
Так, диссоциация ортофосфорной кислоты протекает в три ступени.
![]()
![]()
![]()
Каждой из которых отвечает определённое значение ступенчатой константы диссоциации. Поскольку K1≥K2≥K3, то в наибольшей степени протекает диссоциация по первой ступени, а при переходе к каждой следующей стадии степень диссоциации, как правило, резко уменьшается.
Свойства и устойчивость коллоидов. Коагуляция и седиментация коллоидов.
Размер и масса коллоидных частниц таковы, что наряду с молекулами дисперсионной среды они участвуют в броуновском движении.
Наличие броуновского движения при отсутствии других сил приводит к диффузии коллоидных частниц в объёме раствора и к выравниванию их концентраций по всему объёму.
Свободное оседание частниц под действием гравитационного поля называется седиментацией. Скорость седиментации v пропорциональна ускорению силы тяжести g и зависит от вязкости среду η и размера (радиуса) частиц r:
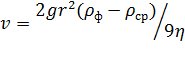
Таким образом, коллоидные частицы под действием силы тяжести стремятся осесть на дно сосуда (или всплыть), тогда как броуновское движение стремится распределить частицы равномерно по всему объёму.
В результате устанавливается седиментационно-диффузионное равновесие – закономерный градиент числа частиц по высоте. В такой системе движущиеся частицы должны сталкиваться. Очевидно, что система окажется устойчивой в том случае, если столкновения будут упругими, иначе частицы начнут слипаться, укрупняться, равновесие нарушится и дисперсная фаза выйдет из раствора.
Процесс слипания частиц, сопровождающийся потерей седиментационной устойчивости, разрушением дисперсной системы и полным разделением фаз, называется коагуляцией.
