
- •Вопросы к экзамену по химии 2 курс.
- •Растворы. Способы выражения концентраций растворов (молярная, моляльная, массовая доля, мольная доля, молярная концентрация эквивалента).
- •Диссоциация комплексных ионов. Константа нестойкости.
- •Осмос. Осмотическое давление растворов, закон Вант-Гоффа.
- •Закон Вант-Гоффа:
- •Электродные потенциалы.
- •Понятие о межфазной энергии и поверхностно-активных веществах.
- •Сильные и слабые электролиты. Степень диссоциации.
- •Слабыми электролитами являются:
- •Шкала электродных потенциалов. Водородный электрод.
- •Комплексные соединения. Их структура.
- •Труднорастворимые электролиты. Произведение растворимости.
- •Электродные реакции. Расчет э.Д.С. Гальванического элемента.
- •Растворимость. Условия образования осадка. Условия растворения осадка.
- •Адсорбция. Поверхностные явления. Поверхностный слой.
- •Электролитическая диссоциация воды. Водородный показатель.
- •Структура комплексных соединений. Ступенчатое комплексообразование.
- •Гидролиз солей.
- •Поверхностные явления. Адсорбция.
- •Адсорбция на границе раствор-пар.
- •Адсорбция на границе твёрдое тело – газ
- •Адсорбция на границе твёрдое тело - раствор.
- •Степень гидролиза. Константа гидролиза.
- •Разрушение комплексных ионов. Константа нестойкости.
- •Факторы, влияющие на степень протекания гидролиза. Необратимый гидролиз.
- •Стандартные окислительно-восстановительные потенциалы.
- •Направление реакций обмена в растворах электролитов. Примеры.
- •Водородный показатель. Методы определения рН растворов.
- •Определение направления реакций окисления-восстановления.
- •Спектральные методы анализа.
- •Потенциометрическое титрование.
- •Методы определения рН.
- •Карбоновые кислоты
- •Электрохимические методы анализа.
- •Систематический качественный анализ
- •Альдегиды и кетоны
Вопросы к экзамену по химии 2 курс.
Растворы. Способы выражения концентраций растворов (молярная, моляльная, массовая доля, мольная доля, молярная концентрация эквивалента).
Раствор – гомогенная система, образованная двумя или более веществами, которые, как правило, подразделяют на растворитель и растворённые вещества.
«Гомогенный» - значит, каждый из компонентов распределён в массе другого в виде своих частиц, то есть атомов, молекул или ионов
Растворитель - компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает.
Если вода является одним из веществ раствора, то, как правило, её считают растворителем.
Раствор находящийся при данных условиях в равновесии с растворяемым веществом, называется насыщенным раствором.
Раствор, в котором при данных условиях предел растворимости не достигнут, называется ненасыщенным.
Важной характеристикой раствора является относительное содержание а нём растворенного вещества и растворителя, которое называется концентрацией.
Качественно растворы делятся на разбавленные, в которых растворённого вещества мало, и концентрированные. в которых растворённого вещества много.
Способы выражения концентраций растворов:
Массовая доля (С) – процентное содержание массы растворённого вещества к общей массе раствора.
Мольная доля (Ni) – отношение количества растворённого вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе. Например, в системе, состоящей из растворителя и единственного растворённого вещества, мольная доля последнего (N2) равна N2=n2/(n1+n2), а мольная доля растворителя (N1) равна N1=n1/(n1+n2), где n1 и n2 – соответственно количество вещества растворителя и количество растворённого вещества.
Молярная концентрация, или молярность (См или M) – отношение числа молей растворённого вещества (количества растворённого вещества) к объёму раствора, выраженному в литрах.
Меняется в зависимости от температуры.
Моляльная концентрация или моляльность (m) – отношение количества вещества массе растворителя, выраженная в килограммах.
Молярная концентрация эквивалента или нормальность (Cн или н.) - отношение числа эквивалентов растворённого вещества к объёму раствора, выраженному в литрах.
Э.Д.С. гальванического элемента. Элемент Даниэля-Якоби.
Гальванический элемент - химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Способен преобразовать энергию химической реакции в электрическую.
Электродвижущая сила (ЭДС) гальванического элемента - максимальное напряжение гальванического элемента, отвечающее обратимому протеканию происходящей в нём реакции. Если реакция протекает в стандартных условиях, то есть, если все вещества, участвующие в реакции, находятся в своих стандартных состояниях, то наблюдаемая при этом ЭДС называется стандартной электродвижущей силой E0.
ЭДС гальванического элемента может быть представлена как разность двух электродных потенциалов φ, каждый их которых отвечает полуреакции, протекающей на одном из электродов. При вычислении электродвижущей силы меньший (в алгебраическом смысле) электродный потенциал вычитается из большего.
Рассмотрим устройство и принцип работы гальванического элемента Даниэля-Якоби. Он состоит из корпуса 1 (рис. 22), разделенного на две части пористой перегородкой 2. В каждую из частей помещаются электроды: медный 3 и цинковый 4. Медный электрод погружается в раствор сульфата меди, цинковый – в раствор сульфата цинка. Пористая перегородка предотвращает смешивание соприкасающихся растворов и пространственно разделяет окислительно-восстановительную реакцию, протекающую при замкнутой внешней цепи: окисление цинка и восстановление меди.
2ē переходят по цепи.
Итак, при работе элемента Даниэля-Якоби протекают процессы:
Окисление цинка:
![]()
Этот процесс окисления называют анодным, а электрод – анодом.
Восстановление ионов меди:
![]()
Процессы восстановления называют в электрохимии катодными, а электроды, на которых идут процессы восстановления – катодами.
![]()
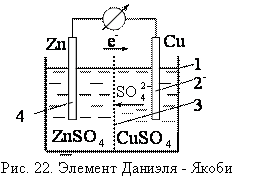
Свойства растворов неэлектролитов. Законы Рауля.
Все растворы обладают способностью к диффузии. Диффузия – стремление вещества равномерно распределиться по всему предоставленному ему объёму.
Процесс односторонней диффузии растворителя через полупроницаемую перегородку называется осмосом.
Равновесное давление раствора, препятствующее диффузии растворителя через перегородку, называется осмотическим давлением.
Ещё одним общим для всех растворов свойством является понижении давления насыщенного пара компонентов по сравнению с соответствующими характеристиками чистых веществ. Давление насыщенного пара определяет при данной температуре равновесие между жидким и газообразным состоянием вещества. Это равновесие устанавливается на границе раздела фаз. Концентрация молекул растворителя в поверхностном слое чистого растворителя, и равновесие может быть достигнуто при меньшем давлении насыщенного пара.
Закон Рауля:
При постоянной
температуре давление насыщенного пара
компонентами идеального раствора
пропорционально его мольной доле в
растворе: ![]()
Где Pi – парциальное давление компонента над раствором, Xi – мольная доля этого компонента, P0i – коэффициент пропорциональности, равный давлению насыщенного пара чистого компонента.
Следствия из закона Рауля:
Температура кипения раствора, содержащего нелетучее растворённое вещество, всегда выше, чем чистого растворителя.
Температура замерзания раствора, содержащего нелетучее растворённое вещество, всегда ниже, чем чистого растворителя.
