
- •Ответы на экзамен физическая химия
- •2) Внутрення энергия. Теплота. Работа и энтальпия
- •3) Теплоемкость
- •4) Закон гесса.
- •5) Зависимость теплового эффекта от температуры
- •6) Второе начало термодинамики.
- •7) Математическая формулировка второго закона термодинамики
- •8) Определение направления самопроизвольного протекания изобарно-изотермического процессов.
- •9) Связь термодинамических потенциалов с работой системы.
- •10) Зависимость энергии Гиббса газа от давления.
- •11) Характеристика химического равновесия.
- •12) Термодинамический вывод закона действующих масс.
- •Перепишем
- •13) Определение направления самопроизвольного протекания реакций. Изотерма реакции.
- •14) Зависимость константы равновесия от температуры. Уравнение изобары и изохоры реакции.
- •15) Принцип подвижного равновесия.
- •16) Тепловая теорема Нернста.
- •17) Расчет константы равновесия с помощью абсолютных значений энтропии.
- •18) Фазовые равновесия.
- •19) Закон равновесия фаз.
- •21) Однокомпонентные системы. Уравнение Клапейрона – Клаузиуса.
- •20) Диаграмма состояния воды.
- •22) Растворы.
- •23) Идеальные растворы.
- •24) Бесконечно разбавленные растворы.
- •25) Реальные растворы.
- •26) Соотношения между составом жидкости и составом пара. Первый закон Гиббса – Кановалова (1886 г.)
- •Азеотропные смеси
- •Анализ диаграммы температура кипения – состав
- •28) Диаграммы равновесия кристаллы – жидкий расплав.
- •29) Бинарные системы с ограниченной взаимной растворимостью жидкостей
19) Закон равновесия фаз.
Правило фаз Гиббса.
Рассмотрим систему, состоящую из К компонентов и Ф фаз.
Для описания состояния этой системы нужно задать температуру, давление, концентрацию каждого компонента в каждой фазе. В равновесии температура и давление в каждой фазе одинаковы.
Для задания состава одной фазы нужно задать (К-1) концентрацию, а для задания состава всех фаз (К-1)Ф концентраций.
Всего (К-1)Ф+2 параметра
Не все параметры в равновесии являются независимыми.
В равновесии:

 -
количество уравнений
-
количество уравнений
Обозначим С – число независимых параметров (число степеней свободы).

Числом степеней свободы называется число параметров, которые можно произвольно изменять в некоторых пределах, не изменяя при этом числа и вида фаз.
Формулировка правила фаз Гиббса.
С=К-Ф+2
Число степеней свободы равновесной термодинамической системы, на которую из внешних параметров могут влиять только температура и давление, равно числу независимых компонентов, минус число фаз, плюс два.
Если на систему влияют другие параметры, кроме давления и температуры (сила тяжести, напряженность электрического поля), то в общем случае
С=К-Ф+N,
где N – число внешних параметров.
Наоборот, если один из параметров: давление или температура не влияют на состояние системы, то условное число степеней свободы

Из правила фаз Гиббса следует
 так
как
так
как

Различают системы:
1-однофазные, двухфазные и тд.
2-однокомпонентные, двухкомпонентные и т.д.
3-инвариантные или безвариантные (С=0);
моновариантные или одновариантные (С=1);
дивариантные или двухвариантные (С=2);
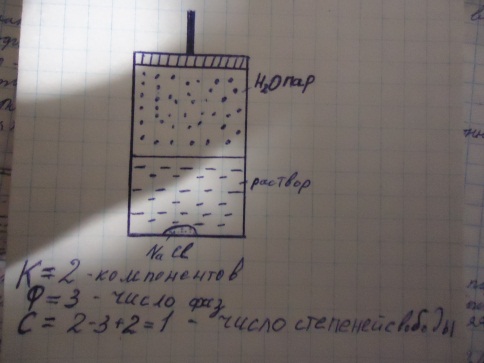
Пример насыщенный раствор NaCl+HOH. Это значит, что только один из трех параметров(давление, концентрация и температура) можно произвольно изменять в некоторых пределах не изменяя при этом числа или вида фаз. Например если повысить температуру, то р и концентрация NaCl увеличатся. Если менять 1 параметр, то остальные параметры меняются вынужденно. Если попытаться увеличить давление опуская вниз поршень уменьшая объем поддерживая Т-const, то давление изменятся не будет, а будет происходить конденсация пара.
21) Однокомпонентные системы. Уравнение Клапейрона – Клаузиуса.
Рассмотрим однокомпонентную систему, состоящую из двух фаз.
 Химический
потенциал компонента в однокомпонентной
системе равняется молярной энергии
Гиббса.
Химический
потенциал компонента в однокомпонентной
системе равняется молярной энергии
Гиббса.

В
равновесии

Если изменить давление и температуру, то молярная энергия Гиббса изменится. Если при этом фазовые равновесия не нарушаются, то

Используя
зависимость энергии Гиббса от давления
и температуры,

получим
 =
= ,
,
где
 - молярный объем и энтропия вещества в
1 и во 2 фазе.
- молярный объем и энтропия вещества в
1 и во 2 фазе.

где
 -
изменение молярного объема и энтропии
при переходе вещества из 1 во 2 фазу.
-
изменение молярного объема и энтропии
при переходе вещества из 1 во 2 фазу.

Так как обе фазы находятся при одинаковой температуре, то фазовый переход является изотермическим.

 уравнение
Клапейрона-Клаузиуса.
уравнение
Клапейрона-Клаузиуса.
Оно справедливо для любых двух фаз и выражает связь давления и температуры при фазовом равновесии.
Анализ уравнения.
Пример: кристаллизация воды
ж→тв



температура увеличивается, давление уменьшается, если сохраняется фазовое равновесие.
тв→ж



давление увеличивается, температура плавления льда понижается.
График зависимости температуры плавления от давления.

Для большинства веществ ∆V при плавлении > 0, поэтому с ростом давления температура плавления увеличивается.
Если одна из двух фаз газообразная, то

Пример: нормальные условия р=1атм, t=0oC, n=1моль, Vгаза=22,4литра, Vжидкое HOH=18мл=0,018л. ж→газ ∆V=22,4-0,018=22,4л
Используя уравнение состояния идеального газа (для 1 моля).

Подставим в уравнение Клапейрона-Клаузиуса.

 уравнение
Клапейрона-Клаузиуса.
уравнение
Клапейрона-Клаузиуса.
Это уравнение справедливо для равновесия двух фаз, одна из которых газообразная.
Анализ уравнения.
При переходе ж→пар


Температура увеличивается, давление насыщенного пара увеличивается.
Интегрируя уравнение Клаперона-Клаузиуса, получим

если


 уравнение
кривой пара.
уравнение
кривой пара.

Измеряя давление насыщенного пара над жидкостью, можно определить теплоту испарения жидкости.
Аналитический метод.
1.

2.

В
не очень большом интервале
 можно принять постоянным.
можно принять постоянным.

Графический метод.
Берем неопределенный интеграл

 уравнение
прямой y=Ax+B
уравнение
прямой y=Ax+B



