
- •Ответы на экзамен физическая химия
- •2) Внутрення энергия. Теплота. Работа и энтальпия
- •3) Теплоемкость
- •4) Закон гесса.
- •5) Зависимость теплового эффекта от температуры
- •6) Второе начало термодинамики.
- •7) Математическая формулировка второго закона термодинамики
- •8) Определение направления самопроизвольного протекания изобарно-изотермического процессов.
- •9) Связь термодинамических потенциалов с работой системы.
- •10) Зависимость энергии Гиббса газа от давления.
- •11) Характеристика химического равновесия.
- •12) Термодинамический вывод закона действующих масс.
- •Перепишем
- •13) Определение направления самопроизвольного протекания реакций. Изотерма реакции.
- •14) Зависимость константы равновесия от температуры. Уравнение изобары и изохоры реакции.
- •15) Принцип подвижного равновесия.
- •16) Тепловая теорема Нернста.
- •17) Расчет константы равновесия с помощью абсолютных значений энтропии.
- •18) Фазовые равновесия.
- •19) Закон равновесия фаз.
- •21) Однокомпонентные системы. Уравнение Клапейрона – Клаузиуса.
- •20) Диаграмма состояния воды.
- •22) Растворы.
- •23) Идеальные растворы.
- •24) Бесконечно разбавленные растворы.
- •25) Реальные растворы.
- •26) Соотношения между составом жидкости и составом пара. Первый закон Гиббса – Кановалова (1886 г.)
- •Азеотропные смеси
- •Анализ диаграммы температура кипения – состав
- •28) Диаграммы равновесия кристаллы – жидкий расплав.
- •29) Бинарные системы с ограниченной взаимной растворимостью жидкостей
16) Тепловая теорема Нернста.
Уравнение Гиббса- Гельмгольца позволяет рассчитать энергию Гиббса реакции ∆G при любой температуре Т. Однако при интегрировании этого уравнения появляются постоянные. Эти постоянные можно определить из опыта, однако в этом случае теория оказывается не полной. Теорема Нернста позволяет рассчитать энергию Гиббса ∆G без экспериментальных данных, использую теплоемкости веществ. Теорема: экспериментально установлено, что при понижении температуры разница между ∆G и ∆H уменьшается.
Постулат Нернста:
В конденсированных системах, вблизи
абсолютного нуля температур, ∆G
и ∆Н совпадают (1 ), имеют общую касательную
(2), параллельную оси температур (3 ).
конденсированных системах, вблизи
абсолютного нуля температур, ∆G
и ∆Н совпадают (1 ), имеют общую касательную
(2), параллельную оси температур (3 ).

Постулат Планка. 3-й закон термодинамики.
При понижении температуры энтропия уменьшается:
Постулат: При абсолютном нуле температур энтропия правильно образованного кристалла любого вещества в чистом виде равна нулю.
 .
.
В любом другом состоянии энтропия > 0 (для смеси веществ, для кристаллов с дефектами при температуре не равной нулю) в статической термодинамике. Следствие: постулат Планка позволяет вычислить абсолютное значение энтропии
при р= const

17) Расчет константы равновесия с помощью абсолютных значений энтропии.

Тепловой эффект реакции при заданной температуре можно найти с помощью Кирхгоффа
 ,
,
а при стандартной температуре- с помощью уравнения Гесса




где
 =
=
Окончательно получим

18) Фазовые равновесия.
Фазовые равновесия – это равновесия в гетерогенных системах, в которых не протекают химические реакции.
Примеры: равновесие жидкость-пар, кристаллы-жидкость, кристаллы-пар.
Основные определения:
Фаза – это совокупность гомогенных частей системы, одинаковых по составу, химическим и физическим свойствам и отделенных от других частей поверхностью раздела.
Компонент (составная часть) – это вещество, которое может быть выделено из системы, и существовать отдельно.
Число независимых компонентов – это наименьшее число компонентов, через которые можно выразить состав любой фазы.
Пример: в газовой фазе 2NO+O2=2NO2, Pобщ=1 атм. Всего компонентов 3, независимых компонентов 2. В равновесии К=Р2 NO2 /P2NO+PO2.
Условие фазового равновесия компонента в различных фазах.
Рассмотрим систему, состоящую из двух фаз α и β, каждая из которых состоит из одного или нескольких компонентов.

 -
химический потенциал ί компонента в
фазе α.
-
химический потенциал ί компонента в
фазе α.
Общая энергия Гиббса всей системы

Пусть
некоторое количество i-го
компонента
 переходит из фазы α в фазу β, тогда
изменение энергии Гиббса в фазе α. и в
фазе β:
переходит из фазы α в фазу β, тогда
изменение энергии Гиббса в фазе α. и в
фазе β:


Изменение общей энергии Гиббса

Если компонент не переходит из фазы α в β, а находится в этих фазах в равновесии, то из общего термодинамического условия равновесия
 получим
получим
 -
условие фазового равновесия
-
условие фазового равновесия
Компонент находится в равновесии в фазах α и β, если его химический потенциал в этих фазах одинаков.
Если химический потенциал компонентов не одинаков, то компонент переходит из одной фазы в другую.
Из общего термодинамического условия самопроизвольного процесса



Компонент самопроизвольно переходит из фазы с большим химическим потенциалом этого компонента в фазу с меньшим химическим потенциалом.
Пример: μi= μi+RTlnPi, NaCl в HOH μ1 HOH> μ2 HOH.
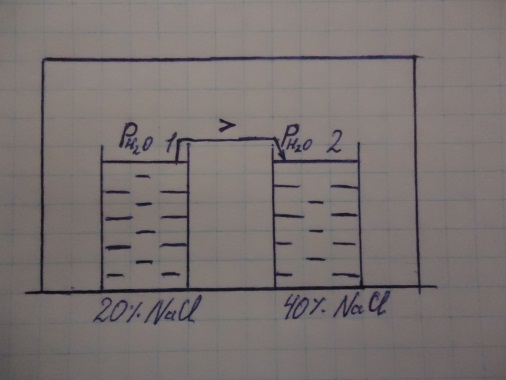
Химический потенциал.
Для однокомпонентной системы зависимость энергии Гиббса от температуры и давления выражается уравнением
.
Для многокомпонентной системы энергия Гиббса зависит не только от температуры и давления, но и от количества каждого компонента
 .
.
При p и T= const

Обозначим

 -
химический потенциал компонента – это
частная производная общей энергии
Гиббса системы по количеству данного
компонента [Дж/моль]. Химический
потенциал имеет смысл энергии Гиббса,
приходящейся на 1 моль данного компонента,
находящегося в смеси с другими
компонентами. Зависимость химического
потенциала от давления такая же, как
и у молярной энергии Гиббса однокомпонентной
системы для идеального газа
-
химический потенциал компонента – это
частная производная общей энергии
Гиббса системы по количеству данного
компонента [Дж/моль]. Химический
потенциал имеет смысл энергии Гиббса,
приходящейся на 1 моль данного компонента,
находящегося в смеси с другими
компонентами. Зависимость химического
потенциала от давления такая же, как
и у молярной энергии Гиббса однокомпонентной
системы для идеального газа

Для неидеального газа нужно заменить на фугитивность f .

 -
относительное давление. Пример:
º=
760 мм .рт .ст .,
= 380 мм. рт. ст. , значит
-
относительное давление. Пример:
º=
760 мм .рт .ст .,
= 380 мм. рт. ст. , значит
 =
0.5 ;
º
=1 атм.,
=0.5 атм., значит
=
0,5. Тогда химический потенциал
=
0.5 ;
º
=1 атм.,
=0.5 атм., значит
=
0,5. Тогда химический потенциал

