
- •Ответы на экзамен физическая химия
- •2) Внутрення энергия. Теплота. Работа и энтальпия
- •3) Теплоемкость
- •4) Закон гесса.
- •5) Зависимость теплового эффекта от температуры
- •6) Второе начало термодинамики.
- •7) Математическая формулировка второго закона термодинамики
- •8) Определение направления самопроизвольного протекания изобарно-изотермического процессов.
- •9) Связь термодинамических потенциалов с работой системы.
- •10) Зависимость энергии Гиббса газа от давления.
- •11) Характеристика химического равновесия.
- •12) Термодинамический вывод закона действующих масс.
- •Перепишем
- •13) Определение направления самопроизвольного протекания реакций. Изотерма реакции.
- •14) Зависимость константы равновесия от температуры. Уравнение изобары и изохоры реакции.
- •15) Принцип подвижного равновесия.
- •16) Тепловая теорема Нернста.
- •17) Расчет константы равновесия с помощью абсолютных значений энтропии.
- •18) Фазовые равновесия.
- •19) Закон равновесия фаз.
- •21) Однокомпонентные системы. Уравнение Клапейрона – Клаузиуса.
- •20) Диаграмма состояния воды.
- •22) Растворы.
- •23) Идеальные растворы.
- •24) Бесконечно разбавленные растворы.
- •25) Реальные растворы.
- •26) Соотношения между составом жидкости и составом пара. Первый закон Гиббса – Кановалова (1886 г.)
- •Азеотропные смеси
- •Анализ диаграммы температура кипения – состав
- •28) Диаграммы равновесия кристаллы – жидкий расплав.
- •29) Бинарные системы с ограниченной взаимной растворимостью жидкостей
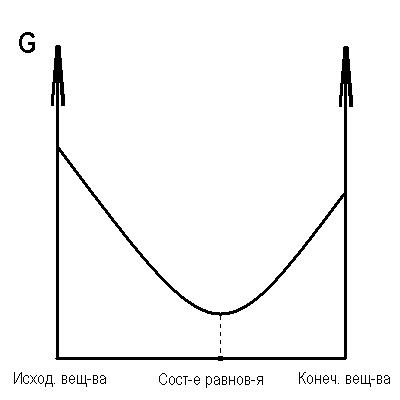
11) Характеристика химического равновесия.
Химическое равновесие характеризуется:
сохранением значения всех параметров при сохранении внешних условий;
динамичностью (равенством скоростей прямой и обратной реакций);
подвижностью (смещением положения равновесия при изменении внешних условий);
возможностью подхода к равновесию с двух сторон;
минимальным значением энергии Гиббса (при p,V = const), или минимальной энергией Гельмгольца (при p, V= const), или максимальным значением энтропии (в изолированной системе).
Кинетический вывод закона действующих масс.
Рассмотрим реакцию

При определенных условиях она протекает как простая. Скорости прямой и обратной реакций определяются соответственно

В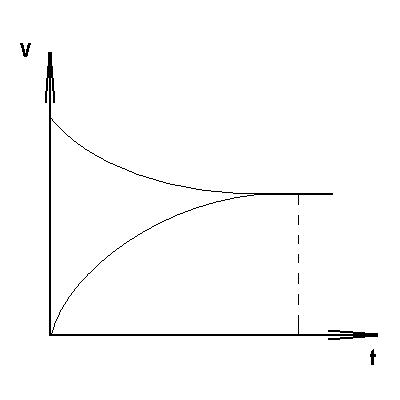 состоянии равновесия
состоянии равновесия

 -
константы скорости прямой и обратной
реакции соответственно. Они не зависят
от концентраций
-
константы скорости прямой и обратной
реакции соответственно. Они не зависят
от концентраций

Левая часть не зависит от концентраций , следовательно и правая часть не зависит от концентраций
 -
константа равновесия.
-
константа равновесия.
 -закон
действующих масс ( Гульдбер, Вааге 1867
год).
-закон
действующих масс ( Гульдбер, Вааге 1867
год).
Смысл: такое соотношение концентраций является величиной постоянной, не зависящей от концентрации.
12) Термодинамический вывод закона действующих масс.
Рассмотрим реакцию , протекающую при постоянных давлении и температуре

Обозначим
количества веществ в исходном состоянии

Пусть в ходе реакции произошло бесконечно малое изменение количеств веществ

„-” для исходных веществ, а ”+„ для продуктов реакции.
 называется
химическая переменная, тогда количества
веществ будут
называется
химическая переменная, тогда количества
веществ будут

Изменение общей энергии Гиббса системы

Для идеального газа используем зависимость химического потенциала от давления


Перепишем

Смысл:
 G
имеет смысл изменения общей энергии
Гиббса системы за один пробег реакции
.
G
имеет смысл изменения общей энергии
Гиббса системы за один пробег реакции
.
Говорят,
что реакция совершила один пробег, если
 молей вещества
молей вещества
 прореагировало с
прореагировало с молями вещества
молями вещества и образовалось
и образовалось молей вещества
молей вещества
 и
и молей вещества
молей вещества .
.
Другое название G –энергия Гиббса реакции.
G – изменение энергии Гиббса за пробег реакции.
Математически G является производной от общей энергии Гиббса по химической переменной.
В равновесии G= 0 , значит

Здесь правая часть не зависит от давления, следовательно, и левая часть не зависит от давления.
Обозначим
правую часть
 ,
,
 -
стандартная константа равновесия, она
не зависит от давления, а зависит от
природы вещества и температуры.
-
стандартная константа равновесия, она
не зависит от давления, а зависит от
природы вещества и температуры.
 -
уравнение закона действующих масс.
-
уравнение закона действующих масс.
Такое соотношение давлений в состоянии равновесия величина постоянная, не зависящая от давления.
Если в состоянии равновесия изменить одно из парциальных давлений или общее давление, то равновесие нарушится, пойдет реакция в прямом или обратном направлении до установления нового состояния равновесия, в котором такое соотношение новых парциальных давлений будет равно прежней константе равновесия.
