
- •Ответы на экзамен физическая химия
- •2) Внутрення энергия. Теплота. Работа и энтальпия
- •3) Теплоемкость
- •4) Закон гесса.
- •5) Зависимость теплового эффекта от температуры
- •6) Второе начало термодинамики.
- •7) Математическая формулировка второго закона термодинамики
- •8) Определение направления самопроизвольного протекания изобарно-изотермического процессов.
- •9) Связь термодинамических потенциалов с работой системы.
- •10) Зависимость энергии Гиббса газа от давления.
- •11) Характеристика химического равновесия.
- •12) Термодинамический вывод закона действующих масс.
- •Перепишем
- •13) Определение направления самопроизвольного протекания реакций. Изотерма реакции.
- •14) Зависимость константы равновесия от температуры. Уравнение изобары и изохоры реакции.
- •15) Принцип подвижного равновесия.
- •16) Тепловая теорема Нернста.
- •17) Расчет константы равновесия с помощью абсолютных значений энтропии.
- •18) Фазовые равновесия.
- •19) Закон равновесия фаз.
- •21) Однокомпонентные системы. Уравнение Клапейрона – Клаузиуса.
- •20) Диаграмма состояния воды.
- •22) Растворы.
- •23) Идеальные растворы.
- •24) Бесконечно разбавленные растворы.
- •25) Реальные растворы.
- •26) Соотношения между составом жидкости и составом пара. Первый закон Гиббса – Кановалова (1886 г.)
- •Азеотропные смеси
- •Анализ диаграммы температура кипения – состав
- •28) Диаграммы равновесия кристаллы – жидкий расплав.
- •29) Бинарные системы с ограниченной взаимной растворимостью жидкостей
25) Реальные растворы.
Признаком идеального раствора является справедливость для раствора закона Рауля.
Идеальный раствор Pi=Pio∙xi

В реальных растворах наблюдаются отклонения от закона Рауля.
Отклонение называется положительными, если давление пара больше чем рассчитанная по закону Рауля.
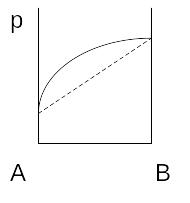
Положительное
отклонение возникает, если силы
взаимодействия между молекулами разных
компонентов меньше чем силы взаимодействия
между молекулами одного и того же
компонента
 .
.
Образование таких растворов сопровождается распадом ассоциатов молекул, поглощением теплоты и увеличением объема.
Отклонение называется отрицательным, если давление пара над раствором меньше чем рассчитанная по закону Рауля.
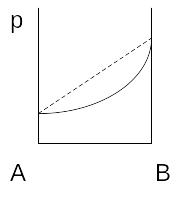
Отрицательные
отклонения возникают, если силы
взаимодействия между молекулами разных
компонентов больше чем силы взаимодействия
между молекулами одного и того же
компонента.

Понятие о термодинамической активности.
Для реальных растворов не справедливы законы идеальных растворов.
Например:
для реального раствора
 ;
химический потенциал реального раствора
;
химический потенциал реального раствора

Для того чтобы сохранить вид законов справедливых для идеальных растворов используют следующий прием: заменяют концентрацию (молярную долю) другой величиной, называемой термодинамической активностью.
Термодинамической активностью компонента раствора называется величина, которую нужно подставить вместо молярной доли в уравнения, справедливые для идеальных растворов, для того чтобы они стали справедливы для реальных растворов.
В
реальном растворе

Закон
Рауля
 - используется для экспериментального
определения термодинамической активности
компонента.
- используется для экспериментального
определения термодинамической активности
компонента.

Вводится коэффициент активности.

Он зависит от природы вещества, температуры, концентрации. Содержится в справочнике.
Зная коэффициент активности саму активность можно найти по формуле.

Для
идеальных растворов
 ;
;
 ;
;

Для растворов с положительными отклонениями.



Для растворов с отрицательными отклонениями



26) Соотношения между составом жидкости и составом пара. Первый закон Гиббса – Кановалова (1886 г.)
Рассмотрим идеальный раствор, находящийся в равновесии со своим паром в закрытом сосуде.
Пар
Жидкость





X ,
,
 - состав па
- состав па
 состав
пара;
состав
пара;
 - состав жидкости;
- состав жидкости;
Согласно
закону Рауля:

Найдем
состав пара:

Если

Состав пара не совпадает с составом жидкости.
Если




Пар по сравнению с жидкостью обогащен вторым компонентом, т. е. тем у которого давление насыщенного пара над чистым компонентом больше (более летучим компонентом).
Диаграмма жидкость - пар

1 –кривая жидкости,
т. е. зависимость общего давления пара
под раствором от состава жидкости. 2 –
кривая пара, т. е. зависимость общего
давления пара под раствором от состава
пара. Эти лини не совпадают, т. к. состав
пара и состав жидкости не одинаков.
Линия пара расположена ниже, т. к.
 .
.
Формулировка первого закона Гиббса – Кановалова: пар по сравнению с жидким раствором богаче тем компонентом, прибавление которого повышает общее давление пара над раствором и соответственно понижает температуру кипения.
