
- •Ответы на экзамен физическая химия
- •2) Внутрення энергия. Теплота. Работа и энтальпия
- •3) Теплоемкость
- •4) Закон гесса.
- •5) Зависимость теплового эффекта от температуры
- •6) Второе начало термодинамики.
- •7) Математическая формулировка второго закона термодинамики
- •8) Определение направления самопроизвольного протекания изобарно-изотермического процессов.
- •9) Связь термодинамических потенциалов с работой системы.
- •10) Зависимость энергии Гиббса газа от давления.
- •11) Характеристика химического равновесия.
- •12) Термодинамический вывод закона действующих масс.
- •Перепишем
- •13) Определение направления самопроизвольного протекания реакций. Изотерма реакции.
- •14) Зависимость константы равновесия от температуры. Уравнение изобары и изохоры реакции.
- •15) Принцип подвижного равновесия.
- •16) Тепловая теорема Нернста.
- •17) Расчет константы равновесия с помощью абсолютных значений энтропии.
- •18) Фазовые равновесия.
- •19) Закон равновесия фаз.
- •21) Однокомпонентные системы. Уравнение Клапейрона – Клаузиуса.
- •20) Диаграмма состояния воды.
- •22) Растворы.
- •23) Идеальные растворы.
- •24) Бесконечно разбавленные растворы.
- •25) Реальные растворы.
- •26) Соотношения между составом жидкости и составом пара. Первый закон Гиббса – Кановалова (1886 г.)
- •Азеотропные смеси
- •Анализ диаграммы температура кипения – состав
- •28) Диаграммы равновесия кристаллы – жидкий расплав.
- •29) Бинарные системы с ограниченной взаимной растворимостью жидкостей
23) Идеальные растворы.
Идеальным называется раствор, в котором силы взаимодействия между молекулами разных компонентов равны силам взаимодействия между молекулами одного и того же компонента.

В природе существуют растворы близкие к идеальным. К ним относятся: смеси изотопов, смеси изомеров, смеси соседних гомологов в рядах органических соединений.
Закон Рауля.
Давление насыщенного пара растворителя над раствором нелетучего вещества прямо пропорционально молярной доле растворителя в растворе.

 -
давление насыщенного пара над чистым
раствором ,
-
давление насыщенного пара над чистым
раствором ,
 -
молярная доля растворителя.
-
молярная доля растворителя.
График зависимости давления пара от состава раствора.
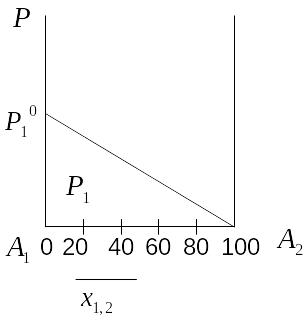

Относительное понижение давления насыщенного пара равно молярной доле растворенного вещества. Оно не зависит от природы растворенного вещества.
Обобщенный закон Рауля.
При больших давлениях насыщенного пара пар может не обладать свойствами идеального газа, хотя раствор остается идеальным.

Признак идеальности раствора.
Раствор, подчиняющийся закону Рауля при всех значениях температуры
и концентрации, является идеальным.
Если оба компонента летучи, то

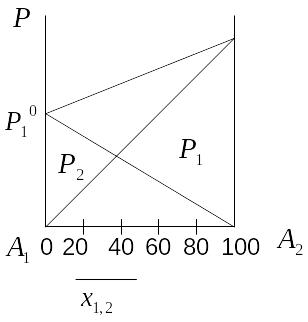
24) Бесконечно разбавленные растворы.
Бесконечно разбавленным раствором называется раствор, в котором молярная доля растворенного вещества бесконечно мала. X2<<1.
В таких растворах для растворителя справедливы законы идеального раствора. Для растворенного вещества законы идеального раствора могут не выполняться.
Понижение температуры замерзания раствора.
Температурой замерзания раствора называется температура, при которой начинается кристаллизация естественного растворителя.
Если давление насыщенного пара над жидкостью и над твердой фазой одинаковы (условие равновесия фаз).
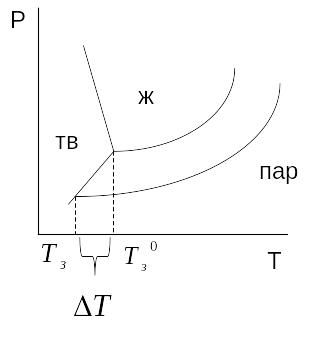 При
растворении нелетучего вещества давление
насыщенного пара растворителя понижается,
в результате температура замерзания
уменьшается.
При
растворении нелетучего вещества давление
насыщенного пара растворителя понижается,
в результате температура замерзания
уменьшается.
Можно показать термодинамически, что в разбавленных растворах (моляльность <1) понижение температуры замерзания прямо пропорционально концентрации растворенного вещества.
 ,
m –
моляльность раствора,
,
m –
моляльность раствора,
 - криоскопическая константа
- криоскопическая константа
Криоскопическая константа зависит от свойств растворителя и не зависит от свойств растворенного вещества.

 -
молярная масса растворителя.
-
молярная масса растворителя.
 -
температура замерзания чистого раствора.
-
температура замерзания чистого раствора.
 -
молярная теплота плавления растворителя.
-
молярная теплота плавления растворителя.
Измеряя температуру замерзания растворов можно определить молярную массу растворенного вещества.


 -
массы растворителя и растворенного
вещества.
-
массы растворителя и растворенного
вещества.
Этот метод определения молярной массы называется криоскопическим.
Если молекулы растворенного вещества в растворе распадаются на более мелкие частицы, то вводится поправочный коэффициент i - изотонический коэффициент.

α – степень диссоциации.
Ν – число частиц, на которые распадается молекула растворенного вещества.
Растворимость газа в жидкостях.
Закон Генри.
Растворимость газа в жидкостях обычно мала, поэтому такие растворы являются разбавленными. Для растворенного вещества (газа) закон Рауля может, не выполнятся, хотя линейная зависимость давления газа над раствором от его молярной доли в растворе выполняется.
Закон Генри.
 ,
,
 - молярная доля газа в растворе, то есть
растворимость,
- молярная доля газа в растворе, то есть
растворимость,
 - давление газа над раствором,
- давление газа над раствором,
 - постоянная Генри.
- постоянная Генри.
Растворимость газа в жидкости прямо пропорционально его давления над раствором.
Закон Генри не выполняется для газов, растворимость которых велика вследствие образования соединений (СО2 , HCl и т.д.)
Зависимость растворимости газов и твердых тел от температуры.
Можно показать, что зависимость растворимости от температуры для идеального или предельно разбавленного раствора описывается уравнением.

В отношении растворимости твердых тел в жидкости это уравнение называется уравнением Шредера.
 -
максимальное содержание растворенного
компонента в растворе (в молярных долях),
то есть растворимость.
-
максимальное содержание растворенного
компонента в растворе (в молярных долях),
то есть растворимость.
 -
дифференциальная теплота (энтальпия)
растворения одного моля вещества в
насыщенном растворе.
-
дифференциальная теплота (энтальпия)
растворения одного моля вещества в
насыщенном растворе.
Анализ уравнение.

1)
тв→ж
 ,
идеальный раствор
,
идеальный раствор
 ,
,
следовательно
 ,
,
 ,
,
с ростом температуры возрастает.
2)
газ→ж
 ,
идеальный раствор
,
,
идеальный раствор
,
следовательно
 ,
,
 ,
,
с ростом температуры уменьшается.
