
- •Ответы на экзамен физическая химия
- •2) Внутрення энергия. Теплота. Работа и энтальпия
- •3) Теплоемкость
- •4) Закон гесса.
- •5) Зависимость теплового эффекта от температуры
- •6) Второе начало термодинамики.
- •7) Математическая формулировка второго закона термодинамики
- •8) Определение направления самопроизвольного протекания изобарно-изотермического процессов.
- •9) Связь термодинамических потенциалов с работой системы.
- •10) Зависимость энергии Гиббса газа от давления.
- •11) Характеристика химического равновесия.
- •12) Термодинамический вывод закона действующих масс.
- •Перепишем
- •13) Определение направления самопроизвольного протекания реакций. Изотерма реакции.
- •14) Зависимость константы равновесия от температуры. Уравнение изобары и изохоры реакции.
- •15) Принцип подвижного равновесия.
- •16) Тепловая теорема Нернста.
- •17) Расчет константы равновесия с помощью абсолютных значений энтропии.
- •18) Фазовые равновесия.
- •19) Закон равновесия фаз.
- •21) Однокомпонентные системы. Уравнение Клапейрона – Клаузиуса.
- •20) Диаграмма состояния воды.
- •22) Растворы.
- •23) Идеальные растворы.
- •24) Бесконечно разбавленные растворы.
- •25) Реальные растворы.
- •26) Соотношения между составом жидкости и составом пара. Первый закон Гиббса – Кановалова (1886 г.)
- •Азеотропные смеси
- •Анализ диаграммы температура кипения – состав
- •28) Диаграммы равновесия кристаллы – жидкий расплав.
- •29) Бинарные системы с ограниченной взаимной растворимостью жидкостей
Ответы на экзамен физическая химия
1) 1.Переход энергии из одной формы в другую (внутренняя энергия, теплота, работа)
2.Энергетические эффекты различных процессов (химическая реакция, фазовые переходы и др.)
3.Возможность, направление и пределы самопроизвольного протекания процесса.
Границы применимости: второй закон термодинамики определяет направление самопроизвольных процессов, справедливых лишь для систем состоящих из большого количества частиц.
Основные понятия:
Система - тело или группа условно обособленных от окружающей среды.
Виды систем: 1) гомогенная – система, внутри которой нет поверхностей раздела.
2) гетерогенная – система, внутри которой есть поверхности раздела.
Однородная система – система, в которой все части обладают одинаковым составом и свойствами.
Неоднородная система - система, в которой не все части обладают одинаковым составом и свойствами.
Изолированная система – система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система - система, которая не обменивается с окружающей средой веществом, но обменивается энергией.
Открытая система - система, которая обменивается с окружающей средой и веществом и энергией.
Параметр состояния – любая величина, которая служит для характеристики системы (температура, давление, концентрация, объем)
Обычно в качестве параметра применяют непосредственно измеряемые величины.
Состояние системы характеризуется совокупностью значений параметров.
Процесс – всякое изменение состояния системы, сопровождающееся изменением хотя бы одного параметра.
Виды процессов:
Круговой (цикл) – процесс, по завершению которого система возвращается в исходное состояние.
Некруговой – процесс, по завершению которого система не возвращается в исходное состояние.
Обратимый – процесс, допускающий возвращение системы в исходное состояние без сопутствующих изменений состояния окружающей среды.
Необратимый – процесс, допускающий возвращение системы в исходное состояние с изменением состояния окружающей среды.
Равновесное состояние – состояние системы, в которой все параметры сохраняют свое значение.
Равновесный процесс – процесс, протекающий через непрерывный ряд равновесных состояний, он протекает бесконечно медленно.
2) Внутрення энергия. Теплота. Работа и энтальпия
Внутренняя энергия U – сумма кинетических энергий хаотического движения всех частиц тела и потенциальной энергии взаимодействия всех частиц тела между собой.
Внутреннюю энергию тела можно изменить двумя способами: теплообменом и совершением работы.
Количество теплоты Q – это та энергия, которая передается при хаотическом соударении молекул.
Работа W – это та энергия, которая передается при перемещении тел или частей тела, она связана с упорядоченным движением частиц.
Будем считать Q>0, если тело получило теплоту
Q<0, если тело отдает теплоту.
Энтальпия H=U+pV
Первое начало термодинамики.
Первое начало термодинамики – это закон сохранения и превращения энергии, приложенный к явлениям, связанным с изменением внутренней энергии.
Опыт показывает, что в круговых процессах W=Q
в не круговых процессах W≠Q
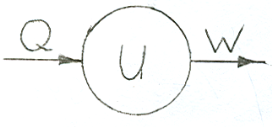
∆U=Q–W
Первая формулировка: превращение внутренней энергии системы равно теплоте, полученной системой, за вычетом работы, совершенной системой.
dU = δQ - δW- для бесконечно малых величин.
Вторая формулировка: в изолированной системе внутренняя энергия остается постоянной.
Третья формулировка: вечный двигатель первого рода невозможен.
Вечный двигатель первого рода – устройство, которое может совершать работу неограниченно долго, не получая энергию извне.
Свойства функций U, H, Q, W.
1) Внутренняя энергия является функцией состояния, это значит, что ее изменение зависит только от начального и конечного состояния
∆U=U2–U1
2) Энтальпия тоже является функцией состояния.
3) Количество теплоты и работа не является функциями состояния, они являются функциями процесса.
Пример.
М атематически
эти свойства выражаются следующим
образом:
атематически
эти свойства выражаются следующим
образом:
бесконечно малое изменение внутренней энергии являются полным дифференциалом

Бесконечно малые изменения количества теплоты и работы не являются полными дифференциалами
 ,
,
 ≠0
≠0
 ≠0
≠0
