
- •Примеры решения задач
- •Степень гидролиза
- •Постулаты
- •17) Периодическое изменение свойств химических элементов
- •Принцип работы гальванического элемента
- •[Править]Вывод уравнения Нернста
- •По природе лиганда
- •Электронное строение
- •Первый закон Фарадея
- •Второй закон Фарадея
- •[Править]Математический вид
- •Описание
- •Окисление
- •Восстановление
- •Окислительно-восстановительная реакция между водородом и фтором
- •Окисление, восстановление
- •[Править]Теперь рассмотрим конкретный пример
- •54) Онно-электронный метод (метод полуреакций)
- •Номенклатура
- •56) 11.3. Энергетические эффекты химических реакций
Принцип работы гальванического элемента
ПРИНЦИП РАБОТЫ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА Простейший гальванический элемент состоит из стеклянного (или другого какого-либо материала) сосуда (рис), внутри которого помещаются на некотором расстоянии друг от друга цинковая и угольная (или медная) пластинки. Эти пластинки обычно называются электродами или полюсами элемента. В сосуд наливается электролит — раствор какой-либо соли или кислот в дистиллированной воде. В результате рисунок. Простейший гальванический элемент. рисунок. Направление тока в гальваническом элементе. химического воздействия электролита на электроды элемента на последних появятся противоположные электрические заряды, причем цинковая пластинка окажется заряженной отрицательно [поэтому она и обозначена на рисунок 1 знаком (—)], а угольная — положительно [обозначена знаком (+)].
25) Концентрационный элемент — это гальванический элемент, состоящий из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными концентрациями С1 > С2. Катодом в этом гальваническом элементе является электрод погруженный в раствор с большей концентрацией, а анодом соответственно погруженным в раствор с меньшей концентрацией[1].
В качестве примера концентрационного элемента можно привести концентрационный свинцовый гальванический элемент. Электроды этого элемента сделаны из свинца, при этом один из электродов которого погружен в раствор соли свинца с концентрацией Pb2+ равной 0,1 моль/л, а другой — в раствор с концентрацией Pb2+ равной 0,01 моль/л.
26) Гальв. Эл. Даниеля-Якоби.
медно-цинковый гальванический
элемент. Состоит
из Си и Zn электродов, к-рые погружены в
р-ры CuSO4 и
ZnSO4 соотв.,
разделенные пористой перегородкой:![]() Источником
электрич. энергии служит своб. энергия
хим. р-ции Zn + + CuSO4->ZnSO4 +
Си. Эдс элемента складывается из разницы
потенциалов электродов, а также
диффузионного потенциала на границе
Источником
электрич. энергии служит своб. энергия
хим. р-ции Zn + + CuSO4->ZnSO4 +
Си. Эдс элемента складывается из разницы
потенциалов электродов, а также
диффузионного потенциала на границе ![]() ;
при 25
;
при 25
27) Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
[Править]Вывод уравнения Нернста
![]() ,
,
где
 —
электродный
потенциал,
—
электродный
потенциал, 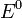 —
стандартный электродный потенциал,
измеряется в вольтах;
—
стандартный электродный потенциал,
измеряется в вольтах; — универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K);
— универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K); —
абсолютная
температура;
—
абсолютная
температура; — постоянная
Фарадея,
равная 96485,35 Кл·моль−1;
— постоянная
Фарадея,
равная 96485,35 Кл·моль−1;— число моль электронов, участвующих в процессе;
 и
и 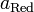 — активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
— активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
Если
в формулу Нернста подставить числовые
значения констант ![]() и
и ![]() и
перейти от натуральных
логарифмов к десятичным,
то при
и
перейти от натуральных
логарифмов к десятичным,
то при ![]() получим
получим
![]()
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом ираствором электролита).
Электродвижущая сила (ЭДС) гальванического элемента зависит от материала электродов и состава электролита. ЭДС описывается термодинамическим функциями, протекающих электрохимических процессов, в виде уравнения Нернста.
28)
29) Комплексные соединения (лат. complexus — сочетание, обхват) или координационные соединения (лат. co — «вместе» иordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемыхлигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
Комплексные соединения мало диссоциируют в растворе (в отличие от двойных солей). Комплексные соединения могут содержать комплексный малодиссоциирующий анион ([Fe(CN)6]3−), комплексный катион ([Ag(NH3)2]+), либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов). Комплексные соединения разнообразны и многочисленны.
