- •§ 1. Педагогические технологии: общая характеристика
- •Структура педагогической технологии
- •2) Содержательная часть обучения:
- •1.2. Основные качества педагогических технологий [22, 23]
- •1.3. Критерии технологичности. Функции, требования, критерии эффективности педагогических технологий [2, 6, 10, 17, 19, 22]
- •1) Организационно-деятельностная функция предполагает:
- •2) Проектировочная (прогностическая) функция отражает:
- •3) Коммуникативная функция предполагает:
- •1.4. Соотношение понятий “педагогическая технология” и “методика обучения”
- •1.5. Классификация педагогических технологий [22, 23, 24]
- •1.6. Целевые установки некоторых педагогических технологий
- •1.7. Описание, анализ и экспертиза педагогической технологии
- •§ 2. Технологии личностно ориентированного и развивающего обучения
- •2.1. Технология педагогических мастерских [6, 22]
- •Принципы построения мастерских [6]
- •2.1.1. Этапы и алгоритмы мастерских [6]
- •2.1.3 Урок - педагогическая мастерская по теме "Линзы. Оптическаясила линзы "
- •2.2. Технология учебного исследования
- •2.3. Технология полного усвоения знаний
- •2.3.1. Применение технологии полного усвоения при изучении темы «Световые явления» 9 класс
- •Лист учета
- •Карточка индивидуального учета для учителя
- •Карточка индивидуального учета для ученика
- •2.4. Технология разноуровневого обучения [11, 17, 22]
- •2.4.1. Методическое обеспечение технологии разноуровневого обучения
- •§ 3. Технологии активизации и оптимизации познавательной деятельности учащихся
- •3.1. Технология проблемного обучения
- •Условия необходимые для осуществления проблемного обучения [14, 15, 16, 19, 22]:
- •Деятельность ученика при разрешении проблемных ситуаций
- •3.1.1. Виды и уровни проблемного обучения
- •3.1.2. Проблемная ситуация как основной элемент проблемного обучения
- •3.1.3 Изучение опыта Резерфорда и ядерной модели атома с применением проблемного обучения
- •Организационный момент.
- •Ход урока Уровень обычной активности
- •Уровень полусамостоятельной активности
- •Уровень самостоятельной активности
- •3.2. Игровая технология
- •3.2.1. Дидактическая игра на обобщающем уроке по теме «Электростатика»
- •1 Задание:
- •2 Задание:
- •3 Задание:
- •1 Задание:
- •Технология коллективного способа обучения [17, 19, 22]
- •Адаптивная технология обучения [17, 19]
- •3.4.1. Типовая схема учебного занятия [19]
- •3.4.2. Урок изучения нового материала по теме «Глаз. Очки.»
- •Ход урока
- •3.6. Технология кооперативного обучения
- •3.6.1. Элементы технологии кооперативного обучения [6, 17, 22]
- •3.6.2. Краткая характеристика ролей в кооперативных группах [14, 15, 16]
- •Рекомендации по подготовке и осуществлению кооперативного обучения.
- •3.6.3. Урок решения задач
- •Ход урока
- •§ 4. Технологии эффективного управления процессом обучения
- •4.1. Технология модульного обучения [10, 11, 17, 19, 22]
- •Система действий учителя по подготовке к переходу на модульное обучение [11, 17, 19, 22]
- •4.1.3. Модули для учителя и ученика по теме «Оптика» (11 класс)
- •Модуль 1 (для ученика). Свет как электромагнитные волны. Скорость света
- •Технология интегрального обучения
- •Идея укрупнения дидактических единиц [22]
- •4.2.2. Проектирование технологии изучения темы [4]
- •4.2.3. Этапы изучения темы
- •4.2.4. Примеры дидактической конструкции темы «Электростатика»
- •Тема №1. Модуль 1. Первый урок. Входной контроль. Вариант 1 Вариант 2
- •Тема №1. Модуль 1. Первый урок. Выходной контроль. Вариант 1 Вариант 2
- •Карта с «белыми пятнами» темы № 1 «Электростатика».
3.1.3 Изучение опыта Резерфорда и ядерной модели атома с применением проблемного обучения
Цели:
Обучающая:
ознакомить
учащихся с опытами Резерфорда и основными
выводами из них. Добиться усвоения
учениками системы знаний по теме ядерная
модель атома. Ознакомить учащихся с
моделью атома Томсона ("пудинговая"
модель) и рассказать о планетарной
модели атома. Показать схему опыта
Резерфорда по рассеянию
![]() -частиц.
-частиц.
Развивающая: развитие интеллекта учащихся, т.е. их познавательной самостоятельности и творческих способностей. Формирование диалектико-материалистического мышления школьников.
Воспитательная: воспитание навыков творческого усвоения знаний, применения знаний. Воспитание всесторонне и гармонично развитой личности.
План урока:
Организационный момент.
Объяснение нового материала с постановкой проблемной ситуации. Столкновение учащихся с жизненными явлениями, фактами, требующими теоретического объяснения. Побуждение учащихся к сравнению, сопоставлению и противопоставлению.
Закрепление материала.
Домашнее задание.
Ход урока Уровень обычной активности
Сегодня на уроке мы познакомимся с моделями атома, а также размерами атома, рассмотрим опыт Резерфорда.
Ученые в 19 веке пытались ответить на вопрос, какое строение имеет атом? То, что атом имеет сложное строение уже было известно. К этому времени были накоплены многие экспериментальные факты. Перечислим некоторые.
В 1785 году Ж.О. Кулон открыл закон взаимодействия заряженных тел. Однако ответить на вопрос, где сосредоточен заряд в атоме, ученые не могли. О том, что атом имеет заряд, говорили опыты по электростатической индукции (наведение заряда на незаряженном теле при поднесении к нему другого заряженного тела), возникновении заряда на теле при трении.
В 1885 году И. Бальмер открывает и описывает линейчатый спектр излучения и спектр поглощения атома водорода, первого элемента периодической системы элементов Д.И. Менделеева. В спектре излучения были видны четыре яркие цветные линии (красная, зеленая, синяя, фиолетовая). Каким образом, атом водорода дает такой спектр, ученые объяснить тоже не смогли.
В 1887 году А.Г. Столетов открывает явление фотоэффекта, когда с поверхности металла под действием электромагнитного излучения уносится отрицательный заряд.
В 1896 году А. Беккерелем открывается новое излучение, которое в последствие было названо радиоактивностью. Непонятным для ученых было свойство атомов (урана) излучать одну и ту же энергию в течение достаточно большого промежутка времени.
Эти и другие экспериментальные факты говорили о сложном строении атома. Но какое строение имеет атом? Давайте попробуем разобраться.
Уровень полусамостоятельной активности
Ученики выдвигают гипотезы, основываясь на жизненном опыте, знаниях, полученных в младших классах. Затем учитель подводит итоги и сообщает новую для учеников информацию.
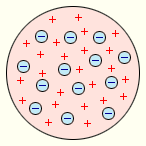
Первая попытка создания модели атома на основе накопленных экспериментальных данных (1903 г.) принадлежит Дж.Томсону. Он считал, что атом представляет собой систему шарообразной формы радиусом, примерно равным 10–10 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него (рис.1). Для объяснения линейчатых спектров испускания атомов Томсон пытался определить расположение электронов в атоме и рассчитать частоты их колебаний около положений равновесия. Однако эти попытки не увенчались успехом. Через несколько лет в опытах великого английского физика Э. Резерфорда было доказано, что модель Томсона неверна.
|
Рис. 1. Модель атома Дж. Томсона
Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э.Резерфордом и его сотрудниками Э. Марсденом и Х.Гейгером в 1909–1911 годах. Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но все же значительно меньше скорости света).
Что представляют собой α-частицы? Это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы.
Почему, как вы думаете?
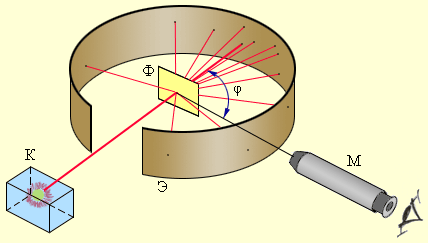
Потому, что масса α-частицы больше массы электрона, а рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда представлена на рис.2.
|
Рисунок 2. Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп |
От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Вспышки на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 90°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Этот результат был совершенно неожиданным даже для Резерфорда. Его представления находились в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома.
Почему Резерфорд получил такой результат, и какая модель атома следует из этого опыта?
Почему α-частица проходящая через фольгу откланяется на значительный угол? Какие силы действуют на нее?
Как и где должен быть сосредоточен положительный заряд в атоме?
При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад. Электрическое поле однородного заряженного шара максимально на его поверхности и убывает до нуля по мере приближения к центру шара. Если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в n раз, то максимальная сила отталкивания, действующая на α-частицу, по закону Кулона возросла бы в n2 раз. Следовательно, при достаточно большом значении n α-частицы могли бы испытать рассеяние на большие углы вплоть до 180°. Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома.