
- •Вопрос51 Брожение-процесс анаэробного расщепления органических веществ, преимущественно углеводов, происходящий под влиянием микроорганизмов или выделенных из них ферментов.
- •Вопрос 54. Всего известно около 3 ооо различных ферментов, их делят на 6 классов.
- •Вопрос 57, 58
- •Вопрос 59.
- •Вопрос 60Уравнение имеет вид:
- •Вопрос 61
- •Вопрос 62 Уравнение Михаэлиса-Ментен - основное уравнение ферментативной кинетики, описывающее зависимость скорости ферментативной реакции от концентрации субстрата.
- •Вопрос 66
- •Вопрос 67
- •Вопрос 70
- •Вопрос 72
- •Вопрос 73
- •Вопрос 74
- •Вопрос 75
- •Вопрос 76
- •Вопрос 77
- •Вопрос 79
- •Вопрос 80
- •Вопрос 81 Биотехнологическое производство дизельного топлива.(хз то или нет, не уверен что это бт производство, думаю что хим производство)
- •Вопрос 82 83 84 Биологическая очистка сточных вод. Аэробные и анаэробные методы очистки.Биологическая очистка сточных вод. (см. Методичку Макарова с.В. На стр. 35-37).
- •Вопрос 85
- •Рекомбинация in vitro днк вектора и днк гена.
- •Введение рекомбинантной плазмиды в клетку.
- •Молекулярное клонирование.
- •Вопрос 90
- •Вопрос 91
- •Вопрос 92
- •Вопрос 93
- •Вопрос 94
- •Вопрос 96
- •Вопрос 97
- •Вопрос 98
- •Вопрос 99
- •Вопрос 1-00ъ
Вопрос 54. Всего известно около 3 ооо различных ферментов, их делят на 6 классов.
1. Оксиредуктазы, или окислительно-восстановительные ферменты (дегидрогеназы, оксидазы, редуктазы, трансгидрогеназы, гидроксилазы). Они катализируют окисление или восстановление различных химических веществ.
2. Трансферазы. Представители этой группы ферментов катализируют перенос различных групп от одной молекулы к другой, например, фосфори-лирование, переаминирование. К ним принадлежат, например, трансамина-зы.
3. Гидролазы (пептидазы, эстеразы, гликозидазы, фосфатазы). Эти ферменты расщепляют белки, жиры и углеводы посредством гидролиза. Играют особенно важную роль в пищеварении и в процессах пищевой технологии.
4. Лиазы. Катализируют реакции расщепления между атомами С; С и О; С и N; С и Hal. К ферментам этой группы относятся, например, декарбок-силазы, отщепляющие молекулу С02 от органических кислот.
5. Изомеразы (рацемазы, эпимеразы). Катализируют структурные изменения в пределах одной молекулы органического соединения.
6. Лигазы (синтетазы). Катализируют образование связей С-О, C-S, С-N, С-С.
В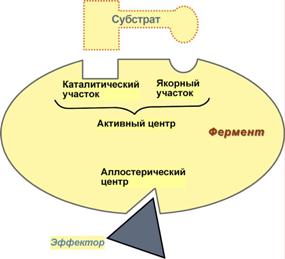 опрос
55В
составе фермента выделяют области,
выполняющие различную функцию:
опрос
55В
составе фермента выделяют области,
выполняющие различную функцию:
1. Активный центр-комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи.
У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора. В свою очередь в активном центре выделяют два участка:
• якорный (контактный, связывающий) - отвечает за связывание и ориентацию субстрата в активном центре,
• каталитический - непосредственно отвечает за осуществление реакции.
2. Аллостерический центр {alios - чужой) - центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции. В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество (см "Регуляция активности ферментов").
Алпостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.
Вопрос 56 Использование очищенных индивидуальных ферментов в промышленности длительное время сдерживалось их дороговизной и невысокой устойчивостью. Ситуация стала изменяться с появлением ферментов, иммобилизованных на нерастворимых носителях. Применение ферментов, достаточно прочно связанных (иммобилизованных) с нерастворимыми полимерными материалами, прежде всего сделало процессы более технологичными. Появилась возможность использовать непрерывные процессы, основанные на пропускании раствора субстрата через колонку с иммобилизованным ферментом. Исчезла проблема отделения прореагировавших компонентов от фермента, резко повысилась эффективность использования фермента. Оказалось также, что связывание с носителем часто повышает термическую устойчивость фермента. В случае протеаз иммобилизация существенно ослабляет взаимодействие между отдельными молекулами фермента, приводящее к самоперевариванию (автолизу). Предложено большое число разнообразных методов иммобилизации, основных как на физической сорбции, так и на ковалентном присоединении белков к носителям. Одним из наиболее популярных химических приемов является обработка глутаровым альдегидом смеси фермента и полимерного носителя, содержащего аминогруппы.
