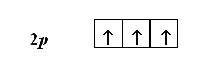- •15. Смещение химического равновесия (принцип Ле-Шателье), факторы влияющие на смещение химического равновесия.
- •16. История формирования современной теории о строении атома: работы Томсона, Резерфорда, Планка, Бора.
- •17. Современная классификация элементарных частиц, понятие «атом».
- •18.Двойственная природа электрона в атоме, уравнение Де-Бройля, понятие электронная орбиталь.
- •19. Квантовые числа электрона в атоме: физический смысл, принимаемые значения.
- •8.Общие представления о строении атома. Квантовые числа электрона, их физический смысл, значения.
- •20.Последовательность распределения электронов по орбиталям в многоэлектронных атомах (принцип min энергии, Паули, правило Гунда и Клечковского)
- •Принцип наименьшей энергии
- •21.Периодический закон и псэ Менделеева: понятие «периоды», «группы», «семейства элементов».
20.Последовательность распределения электронов по орбиталям в многоэлектронных атомах (принцип min энергии, Паули, правило Гунда и Клечковского)
Принцип минимума энергии
Принцип минимума энергии определяет порядок заселения атомных орбиталей, имеющих различные энергии. Согласно принципу минимума энергии, электроны занимают в первую очередь орбитали, имеющие наименьшую энергию. Энергия подуровней растет в ряду:
1s <
2s <
2 p <
3s <
3p <
4s <
3d <
4p <
5s <
4d <
5p <
6s <
4f![]() 5d <
6p <
7s <
5f
6d...
5d <
6p <
7s <
5f
6d...
Принцип наименьшей энергии
В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т.д.
В.М. Клечковский впервые в 1961 г. сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимальным возможным значением n, а с наименьшим значением суммы n + l.
В том случае, когда для двух подуровней суммы значений n и l равны, сначала идет заполнение подуровня с меньшим значением n. Например, на подуровнях Зd, 4р, 5s сумма значений n и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями n, т.е. Зd - 4р – 5s и т.д. В периодической системе элементов Менделеева последовательность заполнения электронами уровней и подуровней выглядит следующим образом
Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом.
Принцип Паули помогает объяснить разнообразные физические явления. Следствием принципа является наличие электронных оболочек в структуре атома, из чего, в свою очередь, следует разнообразие химических элементов и их соединений. Количество электронов в отдельном атоме равно количеству протонов. Так как электроны являются фермионами, принцип Паули запрещает им принимать одинаковые квантовые состояния. В итоге, все электроны не могут быть в одном квантовом состоянии с наименьшей энергией (для невозбуждённого атома), а заполняют последовательно квантовые состояния с наименьшей суммарной энергией (при этом не стоит забывать, что электроны неразличимы, и нельзя сказать, в каком именно квантовом состоянии находится данный электрон). Примером может служить невозбуждённый атом лития (Li), у которого два электрона находятся на 1S орбитали (самой низкой по энергии), при этом у них отличаются собственные моменты импульса и третий электрон не может занимать 1S орбиталь, так как будет нарушен запрет Паули. Поэтому, третий электрон занимает 2S орбиталь (следующая, низшая по энергии, орбиталь после 1S).
Паули
принцип, принцип
запрета, фундаментальный закон природы,
согласно которому две тождественные
частицы с полуцелым спином (в
единицах ![]() )
не могут одновременно находиться в
одном состоянии. Сформулирован в 1925
швейцарским физиком В. Паули для
электронов в атоме, затем распространён
на любые частицы (элементарные частицы,
ядра, атомы, молекулы) с полуцелым спином
(фермионы). В дальнейшем Паули показал,
что принцип запрета является следствием
существующей в релятивистской квантовой
механике связи спина и статистики:
частицы с полуцелым спином подчиняются
Ферми
— Дирака статистике.
В частности, волновая
функция системы
одинаковых фермионов должна быть
антисимметричной относительно
перестановки любых двух фермионов;
отсюда и следует, что в одном состоянии
может находиться не более одного
фермиона.
)
не могут одновременно находиться в
одном состоянии. Сформулирован в 1925
швейцарским физиком В. Паули для
электронов в атоме, затем распространён
на любые частицы (элементарные частицы,
ядра, атомы, молекулы) с полуцелым спином
(фермионы). В дальнейшем Паули показал,
что принцип запрета является следствием
существующей в релятивистской квантовой
механике связи спина и статистики:
частицы с полуцелым спином подчиняются
Ферми
— Дирака статистике.
В частности, волновая
функция системы
одинаковых фермионов должна быть
антисимметричной относительно
перестановки любых двух фермионов;
отсюда и следует, что в одном состоянии
может находиться не более одного
фермиона.
Правило Клечковского гласит:
-
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел
 .
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
.
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением  .
.
орбитальная
энергия последовательно повышается по
мере увеличения суммы
,
причём при одном и том же значении этой
суммы относительно меньшей энергией
обладает атомная орбиталь с меньшим
значением главного квантового
числа
. Например,
при ![]() орбитальные
энергии подчиняются последовательности
орбитальные
энергии подчиняются последовательности ![]() ,
так как здесь для
,
так как здесь для ![]() -орбитали
главное квантовое число наименьшее
-орбитали
главное квантовое число наименьшее ![]() ,
для
,
для ![]() -орбитали
-орбитали ![]() ;
наибольшее
,
-орбиталь
занимает промежуточное положение
;
наибольшее
,
-орбиталь
занимает промежуточное положение ![]() .
.
Или же:
При
заполнении орбитальных оболочек атома
более предпочтительны (более энергетически
выгодны), и, значит, заполняются раньше
те состояния, для которых сумма главного
квантового числа
и
побочного (орбитального) квантового
числа ![]() ,
т.е.
,
имеет меньшее значение.
,
т.е.
,
имеет меньшее значение.
Согласно правилу Гунда, заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным.
Например, атом азота имеет три электрона, находящиеся на 2р-подуровне. Согласно правилу Гунда, они должны располагаться поодиночке на каждой из трех 2р-орбиталей. При этом все три электрона должны иметь параллельные спины: