
- •15. Смещение химического равновесия (принцип Ле-Шателье), факторы влияющие на смещение химического равновесия.
- •16. История формирования современной теории о строении атома: работы Томсона, Резерфорда, Планка, Бора.
- •17. Современная классификация элементарных частиц, понятие «атом».
- •18.Двойственная природа электрона в атоме, уравнение Де-Бройля, понятие электронная орбиталь.
- •19. Квантовые числа электрона в атоме: физический смысл, принимаемые значения.
- •8.Общие представления о строении атома. Квантовые числа электрона, их физический смысл, значения.
- •20.Последовательность распределения электронов по орбиталям в многоэлектронных атомах (принцип min энергии, Паули, правило Гунда и Клечковского)
- •Принцип наименьшей энергии
- •21.Периодический закон и псэ Менделеева: понятие «периоды», «группы», «семейства элементов».
19. Квантовые числа электрона в атоме: физический смысл, принимаемые значения.
Ква́нтовое число́ в квантовой механике — численное значение какой-либо квантованной переменной микроскопического объекта (элементарной частицы, ядра, атома и т. д.), характеризующее состояние частицы. Задание квантовых чисел полностью характеризует состояние частицы. Некоторые квантовые числа связаны с движением в пространстве и характеризуют пространственное распределение волновой функции частицы. Это, например, радиальное (главное) (nr), орбитальное (l) и магнитное (m) квантовые числа электрона в атоме, которые определяются как число узлов радиальной волновой функции, значение орбитального углового момента и его проекция на заданную ось, соответственно. Некоторые другие квантовые числа никак не связаны с перемещением в обычном пространстве, а отражают «внутреннее» состояние частицы. К таким квантовым числам относится спин и его проекция. В ядерной физике вводится также изоспин, а в физике элементарных частиц появляется цвет, очарование, прелесть и истинность.
8.Общие представления о строении атома. Квантовые числа электрона, их физический смысл, значения.
Атом - сложная микросистема, состоящая из микрочастиц (протонов-p+1), нейтронов (n - 0), электрон (e - -1). Протоны и нейтроны - ядро атома.
Электрон - частица и волна. Математически двойственная природа электрона выражается уровнением Луй Де Броиля: L(лямда)=h/m x V, где: L(лямда) - длина волны; h - const Планка; m - масса e; V - скорость его движения (e). Состояние электрона в атоме описывается уравнением волнового типа для стоячей волны.
Уравнение электрических волн было предложено Шреденгером для создания квонтого-механической теории атома(пси-значок). В уравнении Шреденгера смысл имеют квантовые числа, которые показывают расположение электронов по энергитическим уровням, подуровням и орбиталям.
n - главное квантовое число (принимает целочисленное значение от 1 до ... . В периодической систеиме (n) принимает значения от 1 до 7. С возрастанием значения (n) увеличиваются размерыатомной орбитали и их энергия.
l - характеризует форму атомных орбиталей, число подуровней на данном энергитическом уровне, т.е. характерезует энерги. (e), принимает значение l=0...(n-1). Число значений (l) равно числу подуровней на энергитическом уровне и каждый уровень имеет буквенное обозначение:
n = 1, l = 0 => (S) n = 2, l = 0 => (S); l = 1 =>(p) n = 3, l = 0 => (S); l = 1 =>(p); ; l = 2=>(d) n = 4, l = 0 => (S); l = 1 =>(p); ; l = 2=>(d); l = 3=>(f).
Ml - характеризует число орбиталей на данном подуровне.
Принимает значение:
Ml = -l... 0 ...l l = 0 => (S) Ml = 0 - 1 клеточка l = 1 => (p) Ml = -1; 0; 1 - 3 клеточки l = 2 => (d) Ml = -2; -1; 0; 1; 2 - 5 клеточек l = 3 => (f) Ml = -3; -2; -1; 0; 1; 2; 3 - 7 клеточек
Ms - спиновое число характеризует собственный момент вращения электорна и показывает число элеквтронов на 1-ой атомной орбитали.
Ms = 1/2( когда в клетке стрелочка вверх) Ms = -1/2(стрелочка вниз)}- это значит, что на 1-ой орбитали может находится 2-а электрона (могут быть как спаренные (в 1-ой клетке 2-а (e)), так и неспаренные (в 1-ой клетке 1-н (e))).
Главное квантовое число n характеризует энергию электронной орбитали. Главное квантовое число принимает значения 1, 2, 3, 4, 5, 6, 7…∞, обозначаемые также буквами K, L, M, N , O, P, Q … Чем больше n, тем выше энергия орбитали. Переходы электронов с одной орбитали на другую сопровождается излучением или поглощением квантов энергии.
Главное квантовое число характеризует также удаленность максимума электронной плотности от ядра. Чем больше n, тем больше объем орбитали. Совокупность электронов с одинаковым значением n называют энергетическим уровнем или оболочкой, слоем.
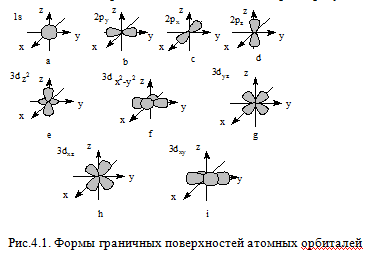
Орбитальное (побочное, азимутальное) квантовое число l принимает значения от 0 до (n-1) и характеризует форму граничной поверхности атомной орбитали. Обозначения: 0-s; 1-p; 2-d; 3-f и т.д. Совокупность электронов, имеющих одинаковые значения l и n, называют энергетическим подуровнем (подоболочкой). Граничная поверхность s-орбиталей имеет форму сферы(рис.4.1,а), р-орбиталей – гантели (рис.4.1,b-d). Граничные поверхности d-орбиталей показаны на рис.4.1,e-i. Форма граничных поверхностей f-орбиталей сложнее, чем d-орбиталей.
Орбитальное квантовое число характеризует также энергию электронов подуровня в пределах данного энергетического уровня.
Энергия подуровней возрастает в ряду s, p, d, f (Es<Ep<Ed<Ef).
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве и может принимать целочисленные значения от +l до –l, включая 0. d-подуровень содержит пять орбиталей, s-подуровень – одну (рис.4.1,a), p-подуровень – три (рис.4.1,b-d), а f-подуровень – семь орбиталей.
Атомной орбиталью называют также волновую функцию, характеризуемую определенным набором трех квантовых чисел
Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси и может принимать два значения - +1/2 и -1/2.
Состояние электрона в атоме полностью характеризуется с помощью четырех квантовых чисел n, l, ml
P.S. Ребят, этот вопрос ваще тупой, хз чего отвечат, поэтому добавлял сюда все подряд.
