
- •Содержание и цели термодинамики. Основные определения. Термодинамическая система, термодинамические параметры, функции состояния.
- •Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы.
- •4.Теплоемкость. Молярная, удельная, изохорная, изобарная теплоемкость. Зависимость теплоемкости от температуры.
- •5. Стандартное состояние вещества. Стандартная теплота образования..
- •6. Тепловой эффект химической реакции. Закон Гесса.
- •8. Энергия Гиббса, стандартная энергия Гиббса. Понятие о химическом потенциале.
- •10. Уравнение изотермы химической реакции. Определение направления химической реакции.
- •11.Принцип смещения равновесий. Примеры его использования.
- •1 2. Оценка состава и свойств газовой атмосферы со –со2 –о2. Условие окисления металла в газовой атмосфере, диссоциации оксида металла.
- •13. Правило фаз Гиббса. Его использование.
- •14. Фазовые превращения 1-го и 2-го рода. Насыщенный пар, упругость пара и ее зависимость от температуры, теплота превращений.
- •15. Фазовые однокомпонентные диаграммы. Уравнение Клапейрона-Клаузиуса.
- •16. Фазовые диаграммы двухкомпонентных систем: компоненты а и в …… (3 фрагмента).
- •18. Растворы. Идеальные растворы. Законы Рауля и Генри. Термодинамическая активность.
- •19. Термодинамические параметры взаимодействия, их использование в расчетах.
- •20. Активность и коэффициент активности компонента металлического раствора и их расчет.
- •21. Кинетика и ее задачи. Кинетическое уравнение. Константа скорости и ее зависимость от температуры (уравнение Аррениуса) , порядок реакции, энергия активации и их определение.
- •22. Гетерогенные процессы. Диффузионная и кинетическая области реагирования. Лимитирующая стадия.
- •23. Концентрационный кислородный гальванический элемент с твердым электролитом. Его устройство, принцип работы. Схема измерения эдс. Температурные пределы использования кислородных датчиков.
- •29. Поверхностно активные вещества. Пав в расплаве железа, их влияние на поверхностное натяжение, краевой угол смачивания .
- •30. Вывести уравнение для расчета растворимости водорода (азота) в жидкой стали
19. Термодинамические параметры взаимодействия, их использование в расчетах.
П
 роизводные
уравнения называются массовыми
параметрами взаимодействия первого и
второго порядков и обозначаются
соответственно
роизводные
уравнения называются массовыми
параметрами взаимодействия первого и
второго порядков и обозначаются
соответственно
 -
массовый параметр
взаимодействия компонента i
с компонентом j первого
порядка.
-
массовый параметр
взаимодействия компонента i
с компонентом j первого
порядка.
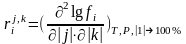 -
массовый параметр
взаимодействия компонента i
с компонентом j второго
порядка
-
массовый параметр
взаимодействия компонента i
с компонентом j второго
порядка
-массовый перекрестный параметр взаимодействия компонента i второго порядка.
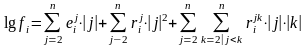
О бычно
температурная зависимость параметров
взаимодействия имеет вид
бычно
температурная зависимость параметров
взаимодействия имеет вид
А и В – компоненты, Т – температура, К.
20. Активность и коэффициент активности компонента металлического раствора и их расчет.
Под активностью компонента в растворе понимают отношение парциального давления пара компонента над раствором к давлению пара этого же вещества, находящегося в стандартном состоянии
А
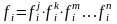 ктивность
имеет тот же физ смысл, что и концентрация,
но учитывает взаимодействие частиц в
растворе
ктивность
имеет тот же физ смысл, что и концентрация,
но учитывает взаимодействие частиц в
растворе

Коэффициент активности количественно характеризует отличие реального раствора от идеального
при определенной концентрации.
Для описания отклонений реальных растворов от закона Генри служит коэффициент активности
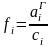
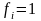
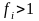 - -в области идеального разбавленного
раствора
- -в области идеального разбавленного
раствора
- При положительных отклонениях от закона Генри
 - При отрицательных отклонениях
- При отрицательных отклонениях
- концентрация i-го компонента металлического расплава, % масс.
21. Кинетика и ее задачи. Кинетическое уравнение. Константа скорости и ее зависимость от температуры (уравнение Аррениуса) , порядок реакции, энергия активации и их определение.
Химическая кинетика – наука, изучающая количественные закономерности химических процессов, протекающих во времени
Основной закон формальной кинетики: скорость реакции в прямом направлении пропорциональна концентрациям реагирующих веществ
Задачи:
-нахождение математического описания зависимости скорости от параметра (Т,С).Найти кинетическое уравнение.
-установление механизма процесса и нахождение кинетических констант
Уравнения, выражающие связь между скоростью реакции и концентрациями,
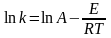
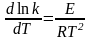 называются
кинетическими
называются
кинетическими
У равнение
Аррениуса:
равнение
Аррениуса:
К-константа скорости. (коэффициент пропорциональности в кинетическом уравнении, связывающем скорость реакции с концентрациями реагирующих веществ и их стехиометрическими коэффициентами)
Порядок реакции (n) – сумма показателей, с которыми концентрации входят в кинетическое уравнение.
Нулевой порядок. (Скорость реакции постоянна и не зависит от времени).

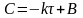

П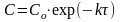 ервый
порядок.(Скорость пропорциональна
концентрации впервой степени
ервый
порядок.(Скорость пропорциональна
концентрации впервой степени
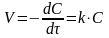

Второй порядокскорость пропорциональна концентрации во второй степени
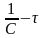
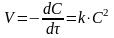
Е – энергия активации процесса (кажущаяся), представляет собой разность
между средней энергией реагирующих частиц и средней энергией всех
частиц, участвующих в соударениях.
