
- •Содержание и цели термодинамики. Основные определения. Термодинамическая система, термодинамические параметры, функции состояния.
- •Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы.
- •4.Теплоемкость. Молярная, удельная, изохорная, изобарная теплоемкость. Зависимость теплоемкости от температуры.
- •5. Стандартное состояние вещества. Стандартная теплота образования..
- •6. Тепловой эффект химической реакции. Закон Гесса.
- •8. Энергия Гиббса, стандартная энергия Гиббса. Понятие о химическом потенциале.
- •10. Уравнение изотермы химической реакции. Определение направления химической реакции.
- •11.Принцип смещения равновесий. Примеры его использования.
- •1 2. Оценка состава и свойств газовой атмосферы со –со2 –о2. Условие окисления металла в газовой атмосфере, диссоциации оксида металла.
- •13. Правило фаз Гиббса. Его использование.
- •14. Фазовые превращения 1-го и 2-го рода. Насыщенный пар, упругость пара и ее зависимость от температуры, теплота превращений.
- •15. Фазовые однокомпонентные диаграммы. Уравнение Клапейрона-Клаузиуса.
- •16. Фазовые диаграммы двухкомпонентных систем: компоненты а и в …… (3 фрагмента).
- •18. Растворы. Идеальные растворы. Законы Рауля и Генри. Термодинамическая активность.
- •19. Термодинамические параметры взаимодействия, их использование в расчетах.
- •20. Активность и коэффициент активности компонента металлического раствора и их расчет.
- •21. Кинетика и ее задачи. Кинетическое уравнение. Константа скорости и ее зависимость от температуры (уравнение Аррениуса) , порядок реакции, энергия активации и их определение.
- •22. Гетерогенные процессы. Диффузионная и кинетическая области реагирования. Лимитирующая стадия.
- •23. Концентрационный кислородный гальванический элемент с твердым электролитом. Его устройство, принцип работы. Схема измерения эдс. Температурные пределы использования кислородных датчиков.
- •29. Поверхностно активные вещества. Пав в расплаве железа, их влияние на поверхностное натяжение, краевой угол смачивания .
- •30. Вывести уравнение для расчета растворимости водорода (азота) в жидкой стали
16. Фазовые диаграммы двухкомпонентных систем: компоненты а и в …… (3 фрагмента).
Рассмотреть превращения при охлаждении и кристаллизации расплава конкретного состава,
применить правило фаз, правило отрезков.
Диаграммы состояния двухкомпонентных систем позволяют определять
число и вид фаз, находящихся в равновесии при определенных условиях,
массовые соотношения между фазами для любой температуры
ДИАГРАММА СОСТОЯНИЯ ДЛЯ СИСТЕМ С
НЕОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ В ЖИДКОМ
СОСТОЯНИИ И ОТСУТСТВИЕМ
РАСТВОРИМОСТИ В ТВЕРДОМ
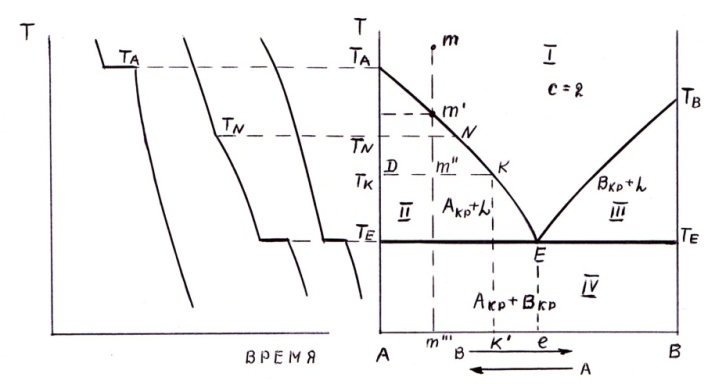
ДИАГРАММА СОСТОЯНИЯ ДЛЯ СИСТЕМ С НЕОГРАНИЧЕННОЙ
РАСТВОРИМОСТЬЮ В ЖИДКОМ И ТВЕРДОМ СОСТОЯНИИ.
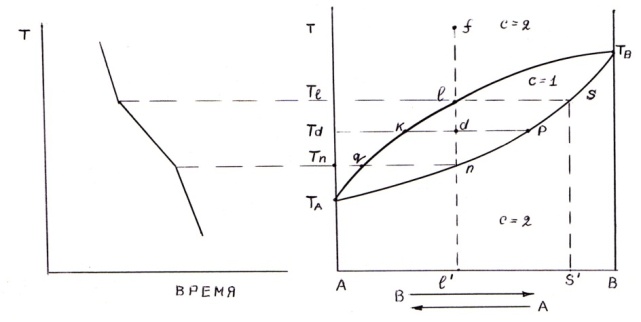
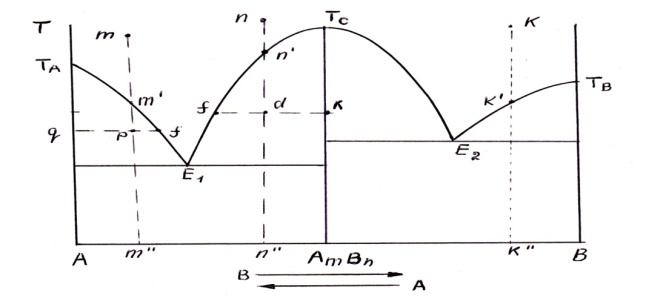
ДИАГРАММА СОСТОЯНИЯ ДЛЯ СИСТЕМ С ПРОЧНЫМ
ХИМИЧЕСКИМ СОЕДИНЕНИЕМ.
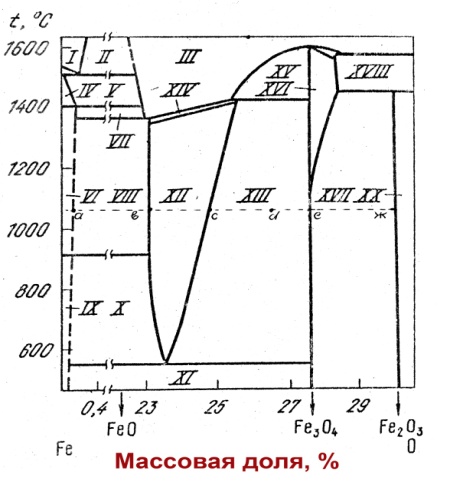
17.Диаграммы
 - Al2O3
( рассмотреть превращения при охлаждении
и кристаллизации расплава), Fe
– O (области смесей,
растворов, назвать последовательно все
фазы, существующие в данной системе при
определенной температуре).
- Al2O3
( рассмотреть превращения при охлаждении
и кристаллизации расплава), Fe
– O (области смесей,
растворов, назвать последовательно все
фазы, существующие в данной системе при
определенной температуре).

18. Растворы. Идеальные растворы. Законы Рауля и Генри. Термодинамическая активность.
Раствором называется однородная, состоящая из 2-х и более веществ система, состав которой может в определенных пределах непрерывно изменяться.
Идеальные растворы – это модели растворов, в которых законы Рауля и Генри выполняются с абсолютной точностью.
Оба закона устанавливают зависимость давления пара компонента
над раствором от концентрации этого компонента в растворе.
Закон Рауля: Важнейшей характеристикой вещества, находящегося в жидком состоянии или твердом является давление насыщенного пара, это давление – константа вещества, определяющая равновесие жидкость ó пар, твердое веществоó пар. Само равновесие достигается, когда процессы испарения компенсируется процессами конденсации. При нагревании давление пара возрастает..
С огласно
этому закону давление пара компонента
прямо пропорционально его мольной доле.
огласно
этому закону давление пара компонента
прямо пропорционально его мольной доле.

 -- давление пара над чистой медью
(Ncu=1)
-- давление пара над чистой медью
(Ncu=1)
 -мольная доля меди в растворе
-мольная доля меди в растворе
Закон Генри: Закон Генри – это положение, согласно которому при постоянной температуре растворимость газа в данной жидкости (выраженная его весовой концентрацией) прямо пропорциональна давлению этого газа над раствором. При этом под растворимостью понимается способность вещества образовывать с другими веществами однородные системы


 -константа ( постоянная ) Генри
зависит от природы компонентов раствора
и от выбранных единиц выражения
концентраций.
-константа ( постоянная ) Генри
зависит от природы компонентов раствора
и от выбранных единиц выражения
концентраций.
-концентрация растворенного компонента .Она может быть выражена в любых единицах, в том числе и в % по массе.
Концентрационный интервал, в котором реальные растворы подчиняются закону Генри, колеблется от долей процента до нескольких процентов.
Под активностью компонента в растворе понимают отношение парциального давления пара компонента над раствором к давлению пара этого же вещества, находящегося в стандартном состоянии
А ктивность
имеет тот же физ смысл, что и концентрация,
но учитывает взаимодействие частиц в
растворе
ктивность
имеет тот же физ смысл, что и концентрация,
но учитывает взаимодействие частиц в
растворе


