
- •Содержание и цели термодинамики. Основные определения. Термодинамическая система, термодинамические параметры, функции состояния.
- •Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы.
- •4.Теплоемкость. Молярная, удельная, изохорная, изобарная теплоемкость. Зависимость теплоемкости от температуры.
- •5. Стандартное состояние вещества. Стандартная теплота образования..
- •6. Тепловой эффект химической реакции. Закон Гесса.
- •8. Энергия Гиббса, стандартная энергия Гиббса. Понятие о химическом потенциале.
- •10. Уравнение изотермы химической реакции. Определение направления химической реакции.
- •11.Принцип смещения равновесий. Примеры его использования.
- •1 2. Оценка состава и свойств газовой атмосферы со –со2 –о2. Условие окисления металла в газовой атмосфере, диссоциации оксида металла.
- •13. Правило фаз Гиббса. Его использование.
- •14. Фазовые превращения 1-го и 2-го рода. Насыщенный пар, упругость пара и ее зависимость от температуры, теплота превращений.
- •15. Фазовые однокомпонентные диаграммы. Уравнение Клапейрона-Клаузиуса.
- •16. Фазовые диаграммы двухкомпонентных систем: компоненты а и в …… (3 фрагмента).
- •18. Растворы. Идеальные растворы. Законы Рауля и Генри. Термодинамическая активность.
- •19. Термодинамические параметры взаимодействия, их использование в расчетах.
- •20. Активность и коэффициент активности компонента металлического раствора и их расчет.
- •21. Кинетика и ее задачи. Кинетическое уравнение. Константа скорости и ее зависимость от температуры (уравнение Аррениуса) , порядок реакции, энергия активации и их определение.
- •22. Гетерогенные процессы. Диффузионная и кинетическая области реагирования. Лимитирующая стадия.
- •23. Концентрационный кислородный гальванический элемент с твердым электролитом. Его устройство, принцип работы. Схема измерения эдс. Температурные пределы использования кислородных датчиков.
- •29. Поверхностно активные вещества. Пав в расплаве железа, их влияние на поверхностное натяжение, краевой угол смачивания .
- •30. Вывести уравнение для расчета растворимости водорода (азота) в жидкой стали
14. Фазовые превращения 1-го и 2-го рода. Насыщенный пар, упругость пара и ее зависимость от температуры, теплота превращений.
Процессы перехода вещества из одной фазы в другую, не сопровождающиеся химическими реакциями, называются фазовыми превращениями.
К фазовым превращениям относятся:
Плавление
Кристаллизация
Испарение и конденсация
Возгонка
Изменение кристаллической модификации и магнитного состояния
Фазовые превращения, сопровождающиеся выделением или поглощением теплоты, которые называются скрытой теплотой превращения, относят к фазовым переходам первого рода.
Переход вещества из одной кристаллической модификации в другую, когда нет выделения или поглощения тепла, относят к фазовым переходам второго рода.
Пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
Давление, при котором существует равновесие, называется давлением (упругостью) насыщенного пара. Важнейшей характеристикой является точка кипения вещества - температура, при которой давление насыщенного пара становится равным
одной атмосфере.Пар, при определенном давлении, имеющий по сравнению с насыщенным
паром более высокую температуру, называется перегретым паром, более низкую – пересыщенным паром.
15. Фазовые однокомпонентные диаграммы. Уравнение Клапейрона-Клаузиуса.
В соответствии с правилами фаз Гиббса для однокомпонентной системы с=1+2-f
При наличии одной фазы с=2 – система бивариантна, если в равновесии две фазы, то c=1 (моновариантна), если в равновесии находятся три фазы с=0 (система нонвариантна).
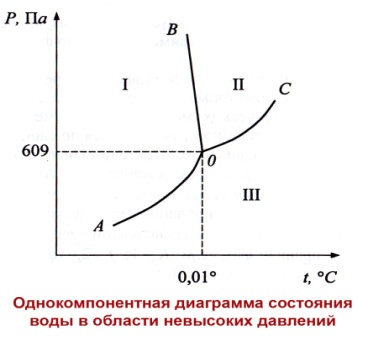
Область I, ограниченная линиями АО и ОВ – это твердая фаза-лед.
При любых температурах и давлениях, отвечающим этой области, устойчиво существует только лед. Если в эти условия поместить пар или жидкую воду, то они превратятся в лед.
Область II, ограниченная ВО и ОС, отвечает условиям существования жидкой воды.
Область III, ограниченная линиями АО и ОС, отвечает условиям существования паровой фазы.
Поскольку для каждой их областей с=2, это означает, что в пределах каждой области можно произвольно изменять температуру и давление без изменения числа фаз.
Кривая ОВ соответствует условиям равновесия: лед-вода,
кривая ОС – условиям равновесия: вода - пар,
кривая АО – условиям равновесия: лед – пар.
Каждая из точек на этих кривых соответствует одновариантной системе с=1+2-2=1, т.е. можно произвольно менять только температуру или только давление.
Причем, каждой определенной температуре соответствует только одно определенное давление и наоборот.
В точке О, называемой тройной точкой, кривые АО, ВО и СО сходятся.
Эта точка отвечает условию трехфазного равновесия, с=0, система нонвариантна.
Координаты тройной точки воды: t=0,0098 ºС, Р=609 Па.
При изменении температуры или давления одна из фаз исчезает, и мы окажемся на линии (двухфазное равновесие) или в одной из трех областей (однофазное равновесие).

Н-теплота фазового перехода
