
- •Предисловие
- •Нульмерные дефекты
- •Одномерные дефекты
- •Трехмерные дефекты
- •1.2. Среда кристаллизации
- •Строение воды и водных растворов *
- •Неводные растворители и растворы
- •Адсорбционный пограничный слой
- •Понятие о примеси и растворителе
- •1.3. Растворимость и движущая сила кристаллизации
- •Вещества, имеющего две полиморфные модификации.
- •1.4. Зарождение кристаллов
- •Гетерогенное зарождение
- •Влияние различных физико-химических факторов на образование зародышей
- •«Размножение» кристаллов
- •Химические закономерности, касающиеся размеров метастабильной области
- •1.5. Механизмы роста кристаллов
- •Нормальный механизм роста
- •Механизм роста трехмерными зародышами
- •1.6. Процесс объемной диффузии при росте кристалла
- •Диффузионные режимы
- •Связь формы кристалла с особенностями диффузионного поля
- •Диффузия и однородность кристалла
- •1.7. Роль сильно адсорбирующихся примесей при кристаллизации
- •Подготовка к выращиванию кристаллов
- •2.1. Сбор сведений, необходимых для выращивания кристаллов
- •2.2. Предварительное ознакомление с ростом кристаллов данного вещества
- •Способы (методы) и методики выращивания кристаллов
- •3.1. Основы классификации способов выращивания кристаллов
- •3.2. Кристаллизация при изменении температуры раствора
- •3.4. Кристаллизация при химической реакции в условиях встречной диффузии
- •3.5. Кристаллизация при рециркуляции растворителя
- •3.6. Кристаллизация при тепловой конвекции раствора
- •3.7. Кристаллизация при концентрационной конвекции раствора
- •3.8. Кристаллизация при вынужденной конвекции раствора
- •3.9. Выбор метода выращивания кристаллов
- •3.10. Пути управления качеством кристалла при его росте
- •I. Диффузионные дефекты
- •II. Адсорбционные дефекты
- •III. Абсорбционные дефекты
- •Приемы работы
- •4.1. Контроль качества и очистки исходных веществ
- •4.2. Приготовление раствора
- •4.3. Определение растворимости
- •4.4. Определение температуры насыщения раствора
- •По наблюдению за конвекционными потоками
- •По измерению электропроводности
- •4.5. Затравочные кристаллы и способы их получения
- •4.6. Кристаллоносцы и способы монтажа затравок
- •4.7. Обращение с выращенным кристаллом
- •4.8. Идентификация кристаллов
- •Техническое оснащение лаборатории
- •5.1. Помещение лаборатории
- •5.2. Оборудование общего назначения
- •5.3. Термостаты
- •5.4. Устройства для автоматического изменения температуры
- •5.5. Устройства для создания относительного движения кристалл — раствор
- •5.6. Приборы для фильтрования и фильтрация
- •5.7. Обработка кристаллов
- •5.8. Материалы, применяемые в кристаллизационной практике
- •1. Примеры веществ, кристаллы которых интересны для изучения некоторых типичных особенностей роста
- •Списки литературы общая к разным главам
- •К главе 1
- •Глава 1. Основные представления теории роста кристаллов из рас творов 5
- •Глава 2. Подготовка к выращиванию кристаллов 62
- •Глава 3. Способы (методы) и методики выращивания кристаллов 70
- •Глава 4. Приемы работы 132
- •Глава 5. Техническое оснащение лаборатории 158
- •Томас Георгиевич Петров, Евгений Борисович Трейвус, Юрий Олегович Пунин, Алексей Прокопьевич Касаткин выращивание кристаллов из растворов
1.4. Зарождение кристаллов
Гомогенное зарождение
Область пересыщенных растворов делится на две подобласти: метастабильных — устойчивых и лабильных — неустойчивых растворов (рис. 1-8 и 1-10). Несмотря на наличие пересыщения, кристаллы в метастабильных растворах самопроизвольно не образуются. Такие растворы могут храниться очень долго при условии, что они были герметизированы в недосыщенном состоянии. Практически кристаллизация в метастабильном растворе происходит только в том случае, если в раствор поместить кристалл-затравку.
На границе с лабильной областью растворы распадаются с самопроизвольным (спонтанным) образованием кристаллов. Эта граница размыта и представляет собой переходную зону, в которой скорости зарождения кристаллов возрастают от нуля до неопределенно больших значений.
Уже в недосыщенных растворах при флуктуациях концентрации возникают области, охватывающие несколько ионов или молекул, в которых расположение частиц отвечает их расположению в соответствующей кристаллической фазе. В метастабильном растворе число таких областей и их размеры возрастают. Однако
23
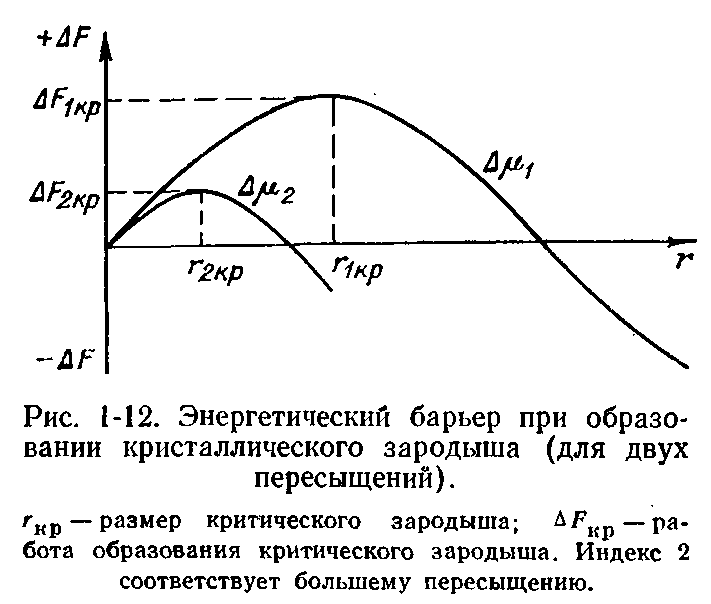
Энергетический барьер при возникновении зародыша характеризуется так называемой работой образования зародыша, рассчитываемой из значений химических потенциалов вещества в растворе и в кристалле и удельной поверхностной энергии кристалла. Эта величина имеет максимум при некотором размере зародыша, называемом критическим (рис. 1-12). Работа образования зародыша и его критический размер rкр уменьшаются с увеличением пересыщения. Устойчиво расти могут только те зародыши, размер которых больше гкр. В метастабильной области размер критического зародыша велик и вероятность кристаллизации крайне мала. Вблизи границы с лабильной областью критический размер уже настолько мал, что вероятность соответствующей флуктуации очень велика, кристаллизация начинается почти мгновенно. Согласно теории, подтвержденной экспериментально, скорость зародышеобразования возрастает с пересыщением по «закону экспоненты» —f(ex).
Существование метастабильной области, в которой центры кристаллизации сами не образуются, собственно, и дает возможность выращивать монокристаллы.
Гетерогенное зарождение
Тщательно очищенные пересыщенные растворы выдерживают переохлаждение на десятки градусов. При отсутствии специальной очистки растворов интервал переохлаждений без возникновения центров кристаллизации составляет первые градусы. Связано это с тем, что работа образования зародышей уменьшается при кристаллизации на инородных частицах. Такое зарождение называется гетерогенным. Можно выделить по меньшей мере два типа механических примесей, уменьшающих ширину метастабильной области и соответственно повышающих вероятность возникновения излишних (паразитических) центров кристаллизации [Овсиенко Д. Е., 1975].
24
Примеси с наведенной активностью — твердые частички, бывшие в контакте с кристаллизуемым веществом и сохранившие его в своих порах. Следы кристаллизуемого вещества приводят к запаразичиванию. Это устраняется при перегреве раствора на 5—10° С выше температуры насыщения в течение нескольких часов.
Примеси с естественной активностью — твердые частицы, структура которых имеет трехмерное или двумерное подобие со структурой кристаллизующегося вещества. В качестве примера укажем на резкое уменьшение ширины метастабильной области в растворах NaCl при внесении в них кристалликов PbS (с 16—20 до 6% в единицах относительного пересыщения) [Овсиенко Д. Е., 1975]. Кристаллы NaCl зарождаются на поверхности кристаллов PbS ориентированно (эпитаксично). Большая активность кристалла по организации около себя слоя с родственной ему структурой может приводить к возникновению на его поверхности кристаллических фаз, неустойчивых в данных условиях в отсутствие подложки. Это иллюстрируется, в частности, образованием высокотемпературных фаз NH4NO3 на различных подложках при комнатных температурах [Хокарт Р., Матье-Сико А., 1950].
