
- •Предисловие
- •Нульмерные дефекты
- •Одномерные дефекты
- •Трехмерные дефекты
- •1.2. Среда кристаллизации
- •Строение воды и водных растворов *
- •Неводные растворители и растворы
- •Адсорбционный пограничный слой
- •Понятие о примеси и растворителе
- •1.3. Растворимость и движущая сила кристаллизации
- •Вещества, имеющего две полиморфные модификации.
- •1.4. Зарождение кристаллов
- •Гетерогенное зарождение
- •Влияние различных физико-химических факторов на образование зародышей
- •«Размножение» кристаллов
- •Химические закономерности, касающиеся размеров метастабильной области
- •1.5. Механизмы роста кристаллов
- •Нормальный механизм роста
- •Механизм роста трехмерными зародышами
- •1.6. Процесс объемной диффузии при росте кристалла
- •Диффузионные режимы
- •Связь формы кристалла с особенностями диффузионного поля
- •Диффузия и однородность кристалла
- •1.7. Роль сильно адсорбирующихся примесей при кристаллизации
- •Подготовка к выращиванию кристаллов
- •2.1. Сбор сведений, необходимых для выращивания кристаллов
- •2.2. Предварительное ознакомление с ростом кристаллов данного вещества
- •Способы (методы) и методики выращивания кристаллов
- •3.1. Основы классификации способов выращивания кристаллов
- •3.2. Кристаллизация при изменении температуры раствора
- •3.4. Кристаллизация при химической реакции в условиях встречной диффузии
- •3.5. Кристаллизация при рециркуляции растворителя
- •3.6. Кристаллизация при тепловой конвекции раствора
- •3.7. Кристаллизация при концентрационной конвекции раствора
- •3.8. Кристаллизация при вынужденной конвекции раствора
- •3.9. Выбор метода выращивания кристаллов
- •3.10. Пути управления качеством кристалла при его росте
- •I. Диффузионные дефекты
- •II. Адсорбционные дефекты
- •III. Абсорбционные дефекты
- •Приемы работы
- •4.1. Контроль качества и очистки исходных веществ
- •4.2. Приготовление раствора
- •4.3. Определение растворимости
- •4.4. Определение температуры насыщения раствора
- •По наблюдению за конвекционными потоками
- •По измерению электропроводности
- •4.5. Затравочные кристаллы и способы их получения
- •4.6. Кристаллоносцы и способы монтажа затравок
- •4.7. Обращение с выращенным кристаллом
- •4.8. Идентификация кристаллов
- •Техническое оснащение лаборатории
- •5.1. Помещение лаборатории
- •5.2. Оборудование общего назначения
- •5.3. Термостаты
- •5.4. Устройства для автоматического изменения температуры
- •5.5. Устройства для создания относительного движения кристалл — раствор
- •5.6. Приборы для фильтрования и фильтрация
- •5.7. Обработка кристаллов
- •5.8. Материалы, применяемые в кристаллизационной практике
- •1. Примеры веществ, кристаллы которых интересны для изучения некоторых типичных особенностей роста
- •Списки литературы общая к разным главам
- •К главе 1
- •Глава 1. Основные представления теории роста кристаллов из рас творов 5
- •Глава 2. Подготовка к выращиванию кристаллов 62
- •Глава 3. Способы (методы) и методики выращивания кристаллов 70
- •Глава 4. Приемы работы 132
- •Глава 5. Техническое оснащение лаборатории 158
- •Томас Георгиевич Петров, Евгений Борисович Трейвус, Юрий Олегович Пунин, Алексей Прокопьевич Касаткин выращивание кристаллов из растворов
1.3. Растворимость и движущая сила кристаллизации
Растворы характеризуются в первую очередь концентрацией составляющих их веществ и температурой.
Р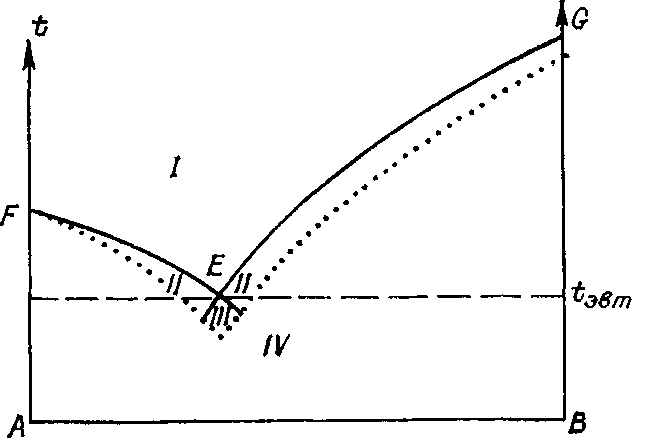 ассмотрим
типичную диаграмму растворимости в
двухкомпонентной
системе (рис. 1-8). Точка А
соответствует
чистому компоненту
А, точка В —
чистому компоненту В, промежуточные
точки
на
линии АВ
отражают
пропорции в составе смеси А+В в
данном
масштабе.
Все поле концентраций разделяется
линией насыщенных
растворов (кривой
растворимости) FEG
на
две области — ненасыщенных
(/) и пересыщенных (//—///) растворов.
В
области ненасыщенных
растворов
происходит
растворение кристаллов,
в
области пересыщенных
растворов
— кристаллизация (правее точки Е
из
растворов
кристаллизуется вещество В, левее—вещество
А). На линии FEG
кристаллы
находятся в равновесии с раствором,
Т. е. не происходит ни роста, ни растворения
ассмотрим
типичную диаграмму растворимости в
двухкомпонентной
системе (рис. 1-8). Точка А
соответствует
чистому компоненту
А, точка В —
чистому компоненту В, промежуточные
точки
на
линии АВ
отражают
пропорции в составе смеси А+В в
данном
масштабе.
Все поле концентраций разделяется
линией насыщенных
растворов (кривой
растворимости) FEG
на
две области — ненасыщенных
(/) и пересыщенных (//—///) растворов.
В
области ненасыщенных
растворов
происходит
растворение кристаллов,
в
области пересыщенных
растворов
— кристаллизация (правее точки Е
из
растворов
кристаллизуется вещество В, левее—вещество
А). На линии FEG
кристаллы
находятся в равновесии с раствором,
Т. е. не происходит ни роста, ни растворения
рис.. 1-8 Диаграмма состояния двухкомпонентной системы с эвтектикой.
Пояснения см. в тексте.
19
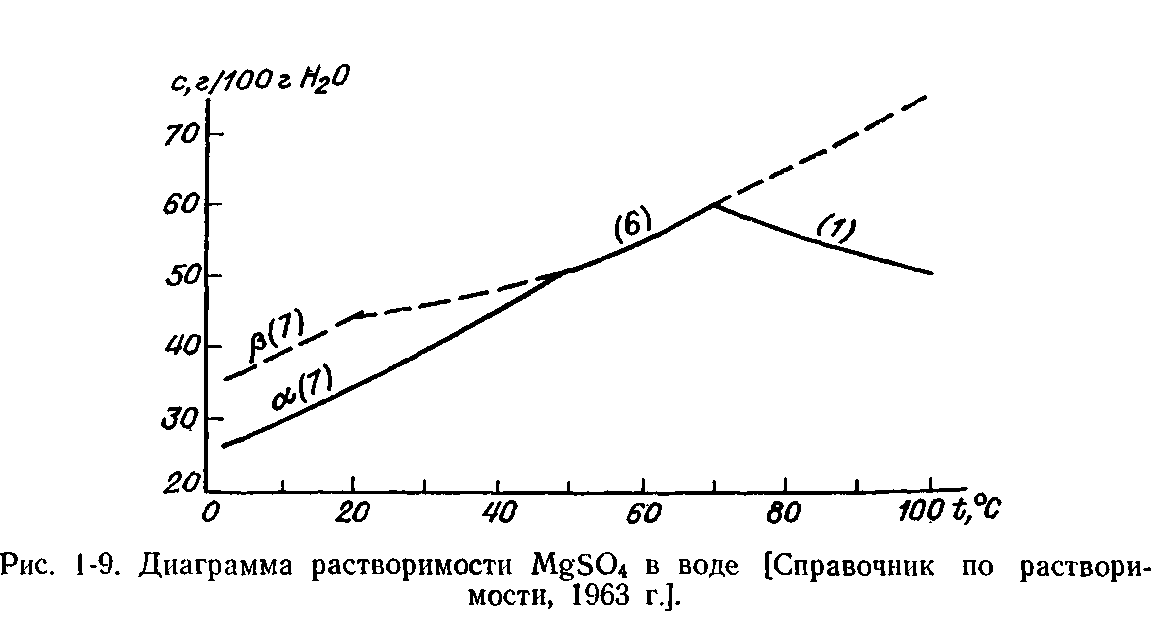
Цифры при кривых в скобках указывают на число молекул воды в соответствующем кристаллогидрате; αиβ —разные модификации.
При этом на линии FЕ раствор насыщен относительно А, на линии EG — относительно В, а в точке Е (эвтектическая точка) — относительно обоих веществ. В области /// происходит кристаллизация обоих веществ. Растворы, имеющие состав, соответствующий области IV, не существуют. Граница между областью IV и лежащей выше областью возможных растворов приблизительна, что связано с особенностями поведения пересыщенных растворов (§ 1.4).
График на рис. 1-8 соответствует случаю, когда компонент А совершенно не входит в структуру кристалла вещества В, и наоборот, т. е. между обоими компонентами нет смесимости в твердом состоянии (вещества не изоморфны между собой).
В качестве растворителя обычно используется вещество с более низкой температурой плавления (в данном случае А), поэтому нас интересует правая часть диаграммы. Как видно на рис. 1-8, концентрация насыщенных растворов В в А растет с увеличением температуры. Это справедливо для подавляющего большинства веществ. Однако в редких случаях растворимость с возрастанием температуры падает: Li2S04, MgSO4. H2O в воде (рис- 1-9).
Растворимость характеризуется абсолютным значением растворимости и ее температурным коэффициентом, который равен изменению растворимости при изменении температуры на 1°С. Температурный коэффициент растворимости может быть как положительным (растворимость растет), так и отрицательным (растворимость падает с температурой).
Если вещество В имеет несколько полиморфных модификаций или кристаллогидратов разной водности, на кривой растворимости обнаруживаются изломы (рис. 1-9 и 1-10), соответствующие температурам превращения этих фаз. Продлив ветви кривой за точку излома на ней в область пересыщенных растворов, получим кривые метастабильного (неустойчивого) равновесия одной кристаллической формы с пересыщенным раствором другой. В поле I
20
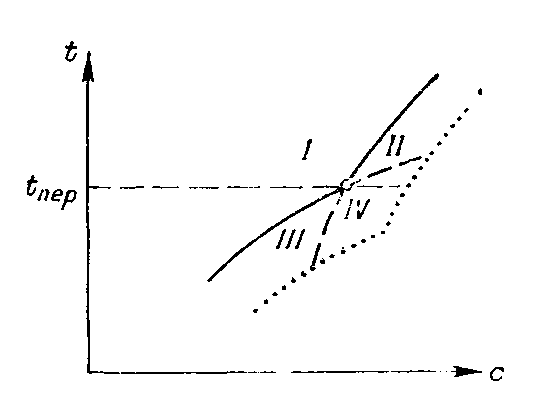
Рис. 1-10. Кривые растворимости для
