
- •Предисловие
- •Нульмерные дефекты
- •Одномерные дефекты
- •Трехмерные дефекты
- •1.2. Среда кристаллизации
- •Строение воды и водных растворов *
- •Неводные растворители и растворы
- •Адсорбционный пограничный слой
- •Понятие о примеси и растворителе
- •1.3. Растворимость и движущая сила кристаллизации
- •Вещества, имеющего две полиморфные модификации.
- •1.4. Зарождение кристаллов
- •Гетерогенное зарождение
- •Влияние различных физико-химических факторов на образование зародышей
- •«Размножение» кристаллов
- •Химические закономерности, касающиеся размеров метастабильной области
- •1.5. Механизмы роста кристаллов
- •Нормальный механизм роста
- •Механизм роста трехмерными зародышами
- •1.6. Процесс объемной диффузии при росте кристалла
- •Диффузионные режимы
- •Связь формы кристалла с особенностями диффузионного поля
- •Диффузия и однородность кристалла
- •1.7. Роль сильно адсорбирующихся примесей при кристаллизации
- •Подготовка к выращиванию кристаллов
- •2.1. Сбор сведений, необходимых для выращивания кристаллов
- •2.2. Предварительное ознакомление с ростом кристаллов данного вещества
- •Способы (методы) и методики выращивания кристаллов
- •3.1. Основы классификации способов выращивания кристаллов
- •3.2. Кристаллизация при изменении температуры раствора
- •3.4. Кристаллизация при химической реакции в условиях встречной диффузии
- •3.5. Кристаллизация при рециркуляции растворителя
- •3.6. Кристаллизация при тепловой конвекции раствора
- •3.7. Кристаллизация при концентрационной конвекции раствора
- •3.8. Кристаллизация при вынужденной конвекции раствора
- •3.9. Выбор метода выращивания кристаллов
- •3.10. Пути управления качеством кристалла при его росте
- •I. Диффузионные дефекты
- •II. Адсорбционные дефекты
- •III. Абсорбционные дефекты
- •Приемы работы
- •4.1. Контроль качества и очистки исходных веществ
- •4.2. Приготовление раствора
- •4.3. Определение растворимости
- •4.4. Определение температуры насыщения раствора
- •По наблюдению за конвекционными потоками
- •По измерению электропроводности
- •4.5. Затравочные кристаллы и способы их получения
- •4.6. Кристаллоносцы и способы монтажа затравок
- •4.7. Обращение с выращенным кристаллом
- •4.8. Идентификация кристаллов
- •Техническое оснащение лаборатории
- •5.1. Помещение лаборатории
- •5.2. Оборудование общего назначения
- •5.3. Термостаты
- •5.4. Устройства для автоматического изменения температуры
- •5.5. Устройства для создания относительного движения кристалл — раствор
- •5.6. Приборы для фильтрования и фильтрация
- •5.7. Обработка кристаллов
- •5.8. Материалы, применяемые в кристаллизационной практике
- •1. Примеры веществ, кристаллы которых интересны для изучения некоторых типичных особенностей роста
- •Списки литературы общая к разным главам
- •К главе 1
- •Глава 1. Основные представления теории роста кристаллов из рас творов 5
- •Глава 2. Подготовка к выращиванию кристаллов 62
- •Глава 3. Способы (методы) и методики выращивания кристаллов 70
- •Глава 4. Приемы работы 132
- •Глава 5. Техническое оснащение лаборатории 158
- •Томас Георгиевич Петров, Евгений Борисович Трейвус, Юрий Олегович Пунин, Алексей Прокопьевич Касаткин выращивание кристаллов из растворов
Неводные растворители и растворы
В настоящее время применение в качестве растворителей при выращивании кристаллов находят спирты, формамид, бензин, диметилсульфоксид, пиридин, ртуть, сложные растворители (водные растворы кислот и другие смеси). Представляют интерес также в качестве растворителей для неорганических солей, например, этиленгликоль, N-метилформамид, этиленкарбонат, пропиленкарбонат. Рассмотрим вкратце некоторые из них.
Одноатомные спирты содержат группы ОН- в молекулах и, следовательно, также могут образовывать водородные связи. Однако поскольку здесь имеется один протон и одна неподеленная пара электронов кислорода, каждая молекула может образовывать водородные связи только с двумя другими молекулами. В результате образуются цепочечные агрегаты с метильными группами наружу. Структура получается довольно компактной, без пустот, и спирты не обладают такими аномальными свойствами, как вода. Многоатомные спирты (глицерин, этиленгликоль) имеют две и более гидроксильных групп на молекулу. Это приводит к образованию пространственной сетки водородных связей, и структура их в жидком состоянии более упорядочена, чем у одноатомных спиртов.
Характеризуя другие неводные растворители, можно сказать, что, в общем, отсутствие водородных связей приводит к компактной, плотноупакованной структуре жидкостей (жидкие углеводороды, СCl4), а наличие таких связей — к более рыхлой структуре (жидкие карбоновые кислоты, формамид и т. д.). Более подробно ознакомиться с неводными растворителями можно, например, по книге Ю. Я. Фиалкова и др. [1973 г.].
Введение ионов в неводные растворители приводит к гораздо меньшему разрушению их структуры, которая и так уже сильно разрушена тепловым движением. В них преобладает упорядочивающее действие сольватированных ионов. Характерным свойством растворов солей в неводных растворителях является также наличие сильной ассоциации ионов, вплоть до их полимеризации [Мищенко К. П., Полторацкий Г. М., 1976].
Температурные особенности физических свойств растворов
Ряд свойств жидкостей: поверхностное натяжение, показатель преломления, плотность и др. — при изменении температуры могут резко изменяться или обнаруживать другие особенности. Например, изобарная теплоемкость воды имеет минимум при 37° С. К этим эффектам приводит скачкообразное изменение квазикристаллической структуры жидкостей. Такие скачки получили название непрерывных фазовых переходов, или гомеоморфных превращений. Подобный скачок
16
может быть и несколько растянутым, но изменение будет все же существенным. Для интересующей нас в первую очередь воды это изменение столь резко выражено, что, как пишет К. П. Мищенко [1959], «можно без особого преувеличения сказать, что воду при 25—75° С и воду вблизи 0°С можно рассматривать как два различных по своей природе растворителя».
Имеются также особенности в физических свойствах растворов, вызванные присутствием растворенного вещества. Так, существуют изломы на графиках, характеризующих тонкую структуру спектра электронного парамагнитного резонанса растворов МnС12 в Н2О при —4, +20 и +30° С. Эти изломы объясняются скачкообразным размораживанием молекул воды соответственно; в третьей, второй и первой гидратных сферах [ЭПР..., 1975].
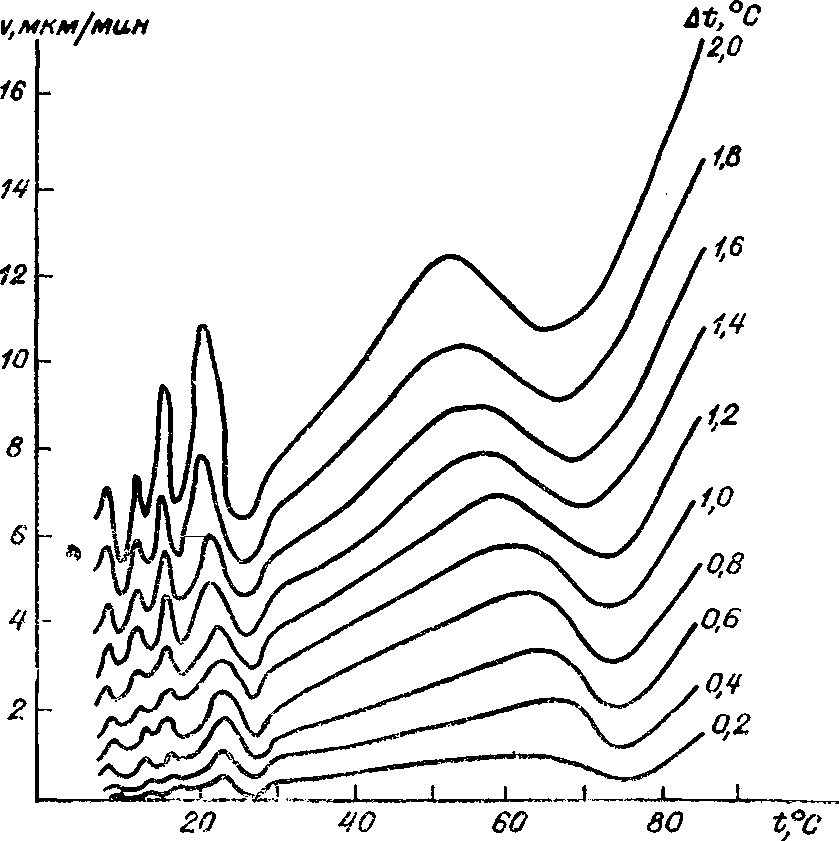
Именно со структурными перестройками в растворе, происходящими при изменении температуры, связывают аномалии скоростей роста граней кристаллов ряда веществ. Явление аномалии скоростей роста заключается в том, что при увеличении температуры скорость роста возрастает не плавно, как это должно быть, а проходит через серию максимумов и минимумов (рис. 1-7). Сейчас аномалии скоростей роста обнаружены примерно для десятка солей, и есть основания считать, что это явление присуще многим, если не всем, веществам.
