
- •Предисловие
- •Нульмерные дефекты
- •Одномерные дефекты
- •Трехмерные дефекты
- •1.2. Среда кристаллизации
- •Строение воды и водных растворов *
- •Неводные растворители и растворы
- •Адсорбционный пограничный слой
- •Понятие о примеси и растворителе
- •1.3. Растворимость и движущая сила кристаллизации
- •Вещества, имеющего две полиморфные модификации.
- •1.4. Зарождение кристаллов
- •Гетерогенное зарождение
- •Влияние различных физико-химических факторов на образование зародышей
- •«Размножение» кристаллов
- •Химические закономерности, касающиеся размеров метастабильной области
- •1.5. Механизмы роста кристаллов
- •Нормальный механизм роста
- •Механизм роста трехмерными зародышами
- •1.6. Процесс объемной диффузии при росте кристалла
- •Диффузионные режимы
- •Связь формы кристалла с особенностями диффузионного поля
- •Диффузия и однородность кристалла
- •1.7. Роль сильно адсорбирующихся примесей при кристаллизации
- •Подготовка к выращиванию кристаллов
- •2.1. Сбор сведений, необходимых для выращивания кристаллов
- •2.2. Предварительное ознакомление с ростом кристаллов данного вещества
- •Способы (методы) и методики выращивания кристаллов
- •3.1. Основы классификации способов выращивания кристаллов
- •3.2. Кристаллизация при изменении температуры раствора
- •3.4. Кристаллизация при химической реакции в условиях встречной диффузии
- •3.5. Кристаллизация при рециркуляции растворителя
- •3.6. Кристаллизация при тепловой конвекции раствора
- •3.7. Кристаллизация при концентрационной конвекции раствора
- •3.8. Кристаллизация при вынужденной конвекции раствора
- •3.9. Выбор метода выращивания кристаллов
- •3.10. Пути управления качеством кристалла при его росте
- •I. Диффузионные дефекты
- •II. Адсорбционные дефекты
- •III. Абсорбционные дефекты
- •Приемы работы
- •4.1. Контроль качества и очистки исходных веществ
- •4.2. Приготовление раствора
- •4.3. Определение растворимости
- •4.4. Определение температуры насыщения раствора
- •По наблюдению за конвекционными потоками
- •По измерению электропроводности
- •4.5. Затравочные кристаллы и способы их получения
- •4.6. Кристаллоносцы и способы монтажа затравок
- •4.7. Обращение с выращенным кристаллом
- •4.8. Идентификация кристаллов
- •Техническое оснащение лаборатории
- •5.1. Помещение лаборатории
- •5.2. Оборудование общего назначения
- •5.3. Термостаты
- •5.4. Устройства для автоматического изменения температуры
- •5.5. Устройства для создания относительного движения кристалл — раствор
- •5.6. Приборы для фильтрования и фильтрация
- •5.7. Обработка кристаллов
- •5.8. Материалы, применяемые в кристаллизационной практике
- •1. Примеры веществ, кристаллы которых интересны для изучения некоторых типичных особенностей роста
- •Списки литературы общая к разным главам
- •К главе 1
- •Глава 1. Основные представления теории роста кристаллов из рас творов 5
- •Глава 2. Подготовка к выращиванию кристаллов 62
- •Глава 3. Способы (методы) и методики выращивания кристаллов 70
- •Глава 4. Приемы работы 132
- •Глава 5. Техническое оснащение лаборатории 158
- •Томас Георгиевич Петров, Евгений Борисович Трейвус, Юрий Олегович Пунин, Алексей Прокопьевич Касаткин выращивание кристаллов из растворов
Механизм роста трехмерными зародышами
Как показал Я. И. Френкель, уже в насыщенном паре в значительном количестве присутствуют комплексы, содержащие более 1000 молекул. При возрастании пересыщения растет уровень флуктуации в растворе, увеличивается его микрогетерогенность. Сильно пересыщенный раствор по строению приближается к коллоидному. Поэтому при больших пересыщениях рост кристалла может идти не только за счет двумерного зарождения на грани, но и путем присоединения уже имеющихся в среде трехмерных агрегатов частиц— «дозародышей» («субмикронных» частиц, «ассоциатов»). С увеличением пересыщения роль этого механизма должна увеличиваться. Вблизи лабильной области описываемый механизм может стать господствующим. Так, X. Пайбст и И. Ноак [Peibst H., Noack J., 1962] показали, что скорость образования зародышей К1 и скорость роста кристаллов КС1 из водных растворов при высоких пересыщениях подчиняются одному закону. Отсюда они сделали вывод, что рост кристаллов КС1 идет за счет присоединения ассоциатов. Соображения в пользу возможности роста кристаллов трехмерными агрегатами высказывались Д. Баларевым [1964], Л. Н. Матусевичем [1968] и др. Однако доказательства существования такого механизма упираются в те же трудности, что и в случае двумерного зародышеобразования. По кривой зависимости скорости роста от пересыщения делать выводы о механизме роста невозможно даже в случае чистых растворов. Существование температурных аномалий скоростей роста (§ 1.2) приводит к тому, что при явно дислокационном механизме роста в разных температурных интервалах можно получить зависимости, отвечающие каким угодно теориям роста. Еще больше дело осложняют примеси, всегда в том или ином количестве присутствующие в растворе.
Внешним признаком обсуждаемого механизма роста считают блочность получающихся кристаллов [Баларев Д., 1964]. Из-за неидеальной гладкости грани и наличия прочно адсорбированных частиц ориентация прилипших дозародышей не всегда строго параллельна основанию. Энергия активации для их переориентации сравнительно велика ввиду их большой массы, а выросший по этому механизму кристалл должен быть плохо образованным — мозаичным, блочным. Причем с увеличением пересыщения количество дозародышей должно возрастать по экспоненциальному закону. Действительно, чем выше пересыщение, тем обычно резче выражена блочность кристаллов. Однако показано [Пунин Ю. О. и др., 1973; Ульянова Т. П. и др., 1973], что при росте из растворов блочные кристаллы образуются за счет иных механизмов (§ 1.8) при явно дислокационном способе роста. Поэтому способ роста кристаллов из растворов трехмерными агрегатами — пока только гипотеза.
38
1.6. Процесс объемной диффузии при росте кристалла
Диффузия — процесс атомно-молекулярного переноса вещества — возникает при наличии разности химических потенциалов между двумя точками в жидкости, аналогично тому как переход вещества из одной фазы в другую возникает при наличии разности химических потенциалов между этими фазами.
Обычное представление о том, что движущей силой диффузии является просто разность концентраций, а диффузия направлена на выравнивание концентраций, не совсем верно. Пример — термодиффузия (эффект Соре), приводящая к возникновению разности концентраций в объеме первоначально однородной по концентрации смеси при наложении на нее разности температур. О разности концентраций можно говорить как о приближенной величине движущей силы диффузии лишь в том частном случае, когда в растворе разность химических потенциалов вызвана только различием концентраций. Именно этот случай мы рассматриваем дальше.
Диффузия вещества к грани кристалла (объемная диффузия) — ведущее явление при кристаллизации, наряду с усвоением вещества кристаллом. Объемная диффузия возникает как следствие снижения концентрации раствора вблизи кристалла при его росте. Оба указанных процесса рассматриваются как основные стадии кристаллизации. Как и в любом многостадийном процессе, каждая из этих стадий в том или ином конкретном случае может лимитировать скорость протекания всего процесса в целом. На основании сказанного выделим три случая.
1. Количество вещества, которое может доставить диффузия при данных условиях (значении движущей силы процесса, температуре, составе среды и т. д.), не ограничивает скорость усвоения вещества кристаллом. В этом случае скорость роста будет полностью определяться скоростью встраивания частиц в кристалл (скоростью межфазной, или адсорбционной, стадии). Такой процесс называют кинетически-лимитируемым (протекающим в кинетической области).
При этом процессе убыль вещества вблизи поверхности кристалла за счет его роста немедленно компенсируется притоком вещества за счет диффузии. Поэтому концентрация раствора вблизи и вдали от кристалла при его росте в кинетической области одинакова (рис. 1-20).
В кинетической области преимущественно растут сингулярные грани при малой их дефектности, а также все грани в присутствии активных примесей (§ 1.7).
39
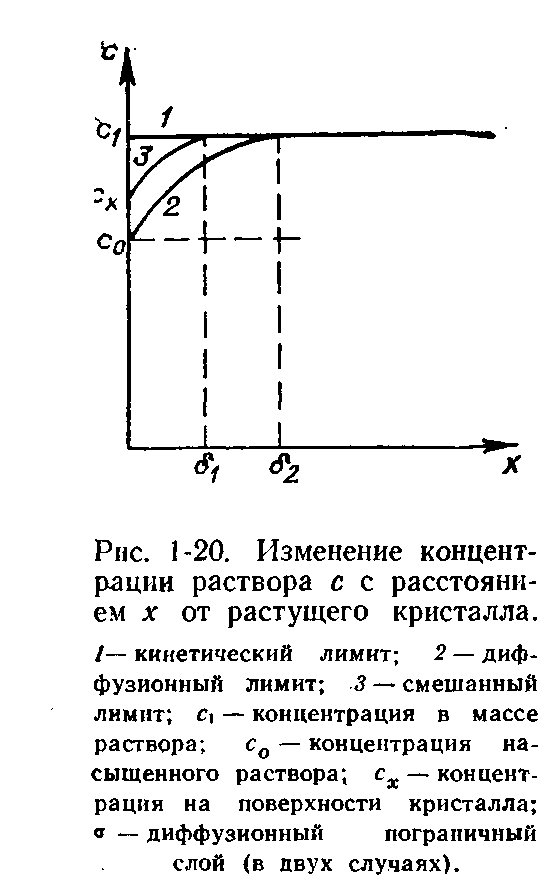
В качестве примера диффузионно-лимитируемого процесса можно привести рост несингулярных поверхностей и растворение кристаллов (по крайней мере в большинстве случаев). 3. Скорости обоих процессов сопоставимы по значениям (кристаллизация в области смешанной кинетики). Этот вариант чаще всего реализуется. Иногда можно говорить о преобладании того или иного типа лимитирования при осуществлении рассматриваемого случая.
В условиях смешанной кинетики концентрация раствора вблизи поверхности грани является промежуточной между той, которая соответствует насыщению, и концентрацией вдали от кристалла (рис. 1-20).
В неподвижной среде слой раствора с пониженной концентрацией вблизи кристалла имеет неопределенные границы. Если же раствор находится в макроскопическом движении относительно кристалла, то слой раствора имеет гораздо более четкий предел. Этот пограничный слой именуется диффузионным (рис. 1-20).
Отметим, что на процесс диффузии влияет выделение теплоты кристаллизации *. Тепловыделение при кристаллизации вдали от температуры плавления невелико и для роста единичных кристаллов малозначимо, однако при массовой кристаллизации его необходимо учитывать.
* Иногда теплота при кристаллизации не выделяется, а поглощается. Это характерно для веществ, обладающих обратной зависимостью растворимости от температуры, в частности для некоторых кристаллогидратов (Nа2СО3* 10Н2О).
40
