
- •Москва «КолосС» 2004
- •Глава 1 регуляция физиологических функций
- •1.1. Понятие о гомеостазе
- •1.2. Гуморальные и нервные механизмы регуляции функций
- •1.3. Единство нервной и гуморальной регуляции
- •1.4. Основные принципы регуляции физиологических функций
- •Глава 2 физиология возбудимых тканей
- •2.1. Физиология процессов возбуждения в нервной системе
- •2.1.1. Структурные особенности нервных клеток и волокон
- •2.1.2. Электрические явления в возбудимых тканях
- •3 А Рис. 2.3. Опыты Гальвани (а) и Маттеучи (б), доказывающие наличие электрических потенциалов в нервно-мышечном препарате:
- •2.1.2.1. Ультраструктурная организация клеточной мембраны
- •2 Рис. 2.4. Схема регистрации мембранного потенциала (а) и фрагмент клеточной мембраны (б) нервной клетки:
- •2.1.2.2. Потенциал покоя
- •2.1.2.3. Роль активного транспорта ионов в формировании мембранного потенциала
- •2.1.2.4. Механизмы генерации потенциала действия
- •Р ис. 2.10. Ионный ток через нервную мембрану при различных фиксированных значениях мембранного потенциала
- •2.1.2.5. Ионные каналы
- •2.1.2.6. Свойства потенциала действия
- •2.1.2.7. Распространение возбуждения
- •2.1.2.8. Передача нервного возбуждения между клетками. Представление о синапсах
- •2.2. Физиологические свойства мыщц
- •2.2.1 .Структурные основы сокращения мышц. Поперечнополосатые мышцы
- •2.2.2. Теория скольжения нитей
- •2.2.3. Электромеханическое скольжение
- •2.2.4. Механика мышцы
- •2.2.5. Метаболические группы поперечнополосатых мышц. Гладкие мышцы
- •Глава 3 физиология системы крови
- •3.1. Значение и функции крови
- •3.2. Количество крови в организме
- •3.3. Состав крови
- •3.4. Физико-химические свойства крови
- •3.5. Гемостаз и свертывание крови
- •3.1. Плазменные факторы свертывания крови
- •3.6. Форменные элементы крови
- •3.7. Регуляция кроветворения
- •3.8. Группы крови
- •3.2. Распределение агглютиногенов и агглютининов в крови системы аво
- •Глава 4 физиология иммунной системы
- •4.1. Структура иммунной системы
- •4.1.1. Центральные органы иммунной системы
- •4.1.2. Периферические органы иммунной системы
- •4.1.3. Клетки иммунной системы
- •4.2. Индукция и регуляция иммунного ответа
- •4.2.1. Антигены
- •4.2.2. Активация лимфоцитов
- •4.2.3. Иммунный ответ гуморального типа
- •4.2.4. Антитела
- •4.2.5. Иммунный ответ клеточного типа
- •4.3. Факторы естественной резистентности
- •4.3.1. Естественные барьеры
- •4.3.2. Система фагоцитов
- •III стадия n стадия
- •4.3.3. Система комплемента, пропердин
- •4.3.4. Лизоцим
- •4.3.5. Интерфероны
- •4.3.6. Взаимодействие антиген—антитело
- •Глава 5 физиология пищеварения
- •5.1. Сущность процесса пищеварения
- •5.2. Физиологические основы голода и насыщения
- •5.3. Методы исследования деятельности пищеварительного тракта
- •5.4. Пищеварение в ротовой полости
- •5.5. Пищеварение в желудке
- •5.1. Функциональное значение секреторных клеток желудка
- •Желудочка по Гейденгайну (а) и и. П. Павлову (б):
- •5.6. Особенности желудочного пищеварения у некоторых видов животных
- •5.7. Пищеварение в тонком кишечнике
- •5.8. Пищеварение в толстом кишечнике
- •5.9. Всасывание
- •Ние. 5.15. Схематическое изображение функционирования сократительной системы апикальной части эпителиальных клеток тонкой кишки
- •5.2. Гормоны желудочно-кишечного тракта
- •5.11. Пищеварение у птиц
- •Глава 6 физиология кровообращения
- •6.1. Физиология сердца
- •6.2. Свойства сердечной мышцы
- •6.3. Сердечный цикл и клапанный аппарат сердца
- •6.1. Частота сокращений сердца в 1 мин
- •6.4. Физические явления, связанные с работой сердца
- •6.2. Систолический и минутный объемы крови у животных
- •6.5. Регуляция работы сердца
- •6.6. Движение крови по кровеносным сосудам
- •6.3. Величина артериального давления у животных, мм рт. Ст.
- •6.7. Регуляция движения крови по сосудам
- •6.8. Особенности кровообращения при различных состояниях организма
- •Глава 7 физиология дыхания
- •7.1. Внешнее дыхание
- •7.3. Изменение давления в грудной полости при дыхании:
- •7.1. Частота дыхательных движений в 1 мин
- •7.2. Газообмен в легких
- •7.3. Транспорт газов кровью, газообмен в тканях
- •7.4. Регуляция дыхания
- •Сосудистых
- •7.5. Особенности дыхания у птиц
- •Глава 8 физиология выделительных процессов
- •8.1. Выделительная функция почек
- •8.2. Структурная организация почек
- •8.3. Мочеобразование
- •8.1. Концентрирующая способность почки
- •8.4. Гомеостатическая функция почек
- •8.2. Факторы, влияющие на клубочковую фильтрацию
- •8.3. Факторы, регулирующие канальцевую реабсорбцию
- •8.5. Регуляция процессов образования мочи
- •8.6. Состав и свойства конечной мочи
- •8.4. Объем мочи, выделяемой за сутки
- •8.7. Механизмы выведения мочи
- •8.8. Выделительная функция кожи
- •Глава 9 физиология размножения
- •9.1. Половое созревание и половая зрелость
- •9.1. Половая и физиологическая зрелость самки
- •9.2. Физиология репродуктивной системы самцов
- •9.2. Средние количественные показатели спермы
- •9.3. Физиология репродуктивной системы самок
- •9.3. Особенности половых циклов
- •9.4. Оплодотворение
- •9.5. Беременность
- •9.6. Различные типы плацент у млекопитающих:
- •9.6. Роды
- •9.4. Продолжительность родов
- •9.7. Послеродовой период
- •9.8. Трансплантация зародышей у животных
- •9.9. Особенности размножения птиц
- •Глава 10 физиология лактации
- •10.1. Развитие молочной железы
- •10.1. Химический состав секретов молочной железы, %
- •10.2. Тип плацентации и пассивная передача иммунитета (X -о — отсутствие передачи)
- •10.4. Пассивный перенос материнских антител
- •10.3. Передача пассивного иммунитета
- •10.2. Биосинтез основных компонентов молока
- •10.3. Физико-химические показатели молока
- •10.4. Структурная организация секреторного процесса
- •10.5. Регуляция секреции молока
- •10.6. Выведение молока
- •10.7. Физиологические основы машинного доения
- •Глава 11 физиология обмена веществ и энергии
- •11.1. Терморегуляция
- •11.1. Ректальная температура у различных видов животных
- •11.2. Белковый (азотистый) обмен
- •11.2.1. Основные этапы белкового обмена
- •11.2.2. Регуляция белкового обмена
- •11.3. Углеводный обмен
- •11.3.1. Основные этапы углеводного обмена
- •11.3.2. Регуляция углеводного обмена
- •11.4. Липидный обмен
- •11.4.1. Основные этапы липидного обмена
- •11.4.2. Регуляция липидного обмена
- •11.5. Обмен воды
- •11.2. Концентрация электролитов в жидкостях организма, мэкв/л
- •11.6. Минеральный обмен
- •11.6.1. Физиологическая роль макроэлементов
- •11.6.2. Физиологическая роль микроэлементов
- •11.6.3. Регуляция минерального обмена
- •11.7. Витамины
- •11.7.1. Жирорастворимые витамины
- •11.7.2. Водорастворимые витамины
- •12.1. Механизмы взаимодействия гормона с клетками
- •12.2. Общие механизмы регуляции внутренней секреции
- •12.1. Нейрогормоны гипоталамо-гипофизарной системы
- •12.3. Гипофиз
- •12.4. Щитовидная железа
- •12.5. Надпочечники
- •12.6. Поджелудочная железа. Внутренняя секреция
- •12.7. Эндокринная функция половых желез
- •12.8. Тимус
- •12.9. Эпифиз
- •12.10. Тканевые гормоны
- •12.11. Гормоны и продуктивность животных
- •Глава 13
- •13.1. Нейроны и синапсы
- •13.2. Рефлекторная деятельность
- •13.3. Свойства нервных центров
- •13.4. Координация рефлекторных процессов
- •13.5. Частная физиология
- •13.5.1. Спинной мозг
- •Ного мозга по Рекседу. Цифрами обозначены слои нерв пых клеток
- •13.5.2. Продолговатый мозг и варолиев мост
- •13.5.3. Средний мозг
- •13.5.4. Ретикулярная формация
- •13.5.5. Мозжечок
- •13.5.6. Промежуточный мозг
- •13.5.7. Подкорковые ядра
- •13.6. Физиология вегетативной нервной системы
- •13.1. Строение и функции симпатической и парасимпатической нервных систем
- •Глава 14
- •14.1. Понятие о нервизме
- •14.2. Методы исследования функций коры больших полушарий
- •14.3. Характеристика условных рефлексов и механизм их образования
- •Слуховая
- •14.4. Торможение условных рефлексов
- •14.5. Взаимоотношения возбуждения и торможения в коре больших полушарий
- •14.6. Типы высшей нервной деятельности
- •14.7. Сон и гипноз
- •14.8. Две сигнальные системы действительности
- •14.9. Теория функциональных систем
- •Глава 15 физиология анализаторов
- •15.1. Рецепторные клетки — начальное звено анализатора
- •15.2. Двигательный анализатор
- •15.2.1. Мышечное веретено
- •15.2.2. Сухожильный рецептор гольджи
- •15.2.3. Рефлекс на растяжение мышцы
- •15.3. Кожный анализатор
- •15.3.1. Механорецепторы кожи
- •15.3.2. Терморецепторы кожи
- •15.3.3. Болевые рецепторы кожи
- •15.4. Обонятельный анализатор
- •Рецептора:
- •15.5. Вкусовой анализатор
- •15.6. Слуховой анализатор
- •Активности:
- •15.7. Анализатор положения тела в пространстве
- •15.8. Зрительный анализатор
- •15.8.1. Структура и функция сетчатки
- •15.8.2. Цветовое зрение
- •15.8.3. Переработка зрительных сигналов в сетчатке
- •15.8.4. Защитный аппарат глаза
- •15.9. Анализаторы внутренней среды opi лии 1мл
- •15.9.1. Висцеральные механорецепторы
- •15.9.2. Висцеральные терморецепторы
- •15.9.3. Висцеральные хеморецепторы
- •15.9.4. Болевые висцеральные рецепторы
- •Глава 16 этология
- •16.1. Формы поведения
- •16.2. Поведенческие реакции
- •16.3. Факторы, влияющие на поведение
- •Оглавление
- •Глава 1. Регуляция физиологических функций (т. А. Эйсымонт) 17
- •Глава 2. Физиология возбудимых тканей (к п. Алексеев) 27
- •Глава 7. Физиология дыхания (т. А. Эйсымонт) 291
- •Глава 9. Физиология размножения (и. О. Боголюбова) 351
- •Глава 10. Физиология лактации (в. Г. Скопичев) 392
- •Глава 12. Физиология эндокринной системы (в. Г. Скопичев) 483
- •Глава 13. Физиология центральной нервной системы (а. И. Енукашвили) 544
- •Глава 15. Физиология анализаторов (н.П.Алексеев) 628
- •Глава 16. Этология (т.А. Эйсымонт).., 697
- •214000, Г. Смоленск, проспект им. Ю. Гагарина, 2.
4.2.4. Антитела
Антителам присущи следующие основные биологические
свойства.
1. Специфичность — способность Ig реагировать только с определенным антигеном, что обусловлено наличием у них антидетерминант, контактирующих с соответствующими детерминантами.
2 Валентность — количество антидетерминант в молекуле антитела. Чаще всего антитела бивалентны, но существуют 5- и даже 10-валентные.
3. Аффинность, аффинитет — прочность соединения между детерминантами (эпитопом) антигена и антидетерминантами (пара-топом) антигена.
4 Авидность — прочность связи антигена с антителом, ълаго-даря поливалентности антигена связь между двумя антигенами осуществляется при помощи нескольких антител.
5. Гетерогенность — неоднородность, обусловленная наличием трех видов антигенных детерминант:
A. Изотипические, характеризующие принадлежность Ig к оп ределенному классу;
Б. Аллотипические, соответствующие аллельным вариантам иммуноглобулина;
B. Идиотипические, отражающие индивидуальные особеннос ти иммуноглобулина.
Организм способен реагировать на поступление чужеродных антигенов синтезом белков, обладающих специфическим срод-
157
ством с антигеном, вызвавшим этот синтез. Эти белки получили название антител. Хотя антитела отличаются друг от друга не только по способности связывать разные антигены, но и по своим физико-химическим свойствам, структурно все они сходны. Эта высокоспециализированная группа белков, построенных из поли-пептидных цепей двух основных типов (легких и тяжелых), получила название иммуноглобулинов.
Иммуноглобулины синтезируются в пузырьках пластинчатого аппарата (Гольджи) В-лимфоцитов. По мере созревания пузырек подходит к поверхности клетки, при контакте с ней происходит разрыв наружной мембраны клетки и мембраны пузырька. Свободные иммуноглобулины поступают в плазму, а связанные с мембраной остаются на поверхности клетки. Таким образом, итоговой фазой В-клеточного иммунитета является продукция /g-антител, которая происходит постоянно. Одновременно в организме синтезируются до 105... 107 антител различной специфичности. Интактный В-лимфоцит синтезирует в один час примерно 250...500 молекул IgM и большую часть их отдает в экстрацеллю-лярную жидкость. После специфической антигенной стимуляции и трансформации лимфоцитов в плазматические клетки этот синтез возрастает в тысячи раз.
Наиболее полно изучено строение антител, представленных иммуноглобулинами класса G (рис. 4.5).
На схеме видно, что молекула IgG под действием протеолити-ческого фермента папаина расщепляется на три больших фрагмента. Два из них идентичны и обладают свойством взаимодействовать с одной молекулой антигена. Они были обозначены как Fab-фрагменты (Fragment antigen binding), связывающие антиген.
Г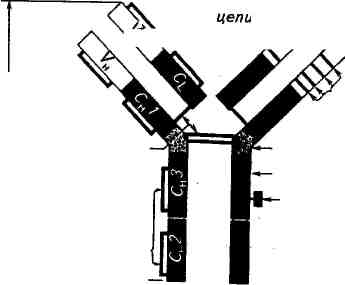 ипервариабельные
участки легкой цепи Лёгкая
м
цепь
ипервариабельные
участки легкой цепи Лёгкая
м
цепь
Рис. 4.5. Структура молекулы иммуноглобулина G
VL и Vfj: вариабельные области Ci и Сн'- константные области
Внутрицепьевые
дисульфидные
связи
функции)
(Эффекторные I биологические Fc
Шарнирная область
Участок связывания
комплемента Углевод
Межцепьевые
" дисульфитные
связи
Гипервариабельные
участки тяжелой
цепи
(Связывание _ антигена) F°°
Тяжёлая цепь v*v /^Тяжелая цепь
Третий фрагмент, содержащий углеводный компонент, был получен при изучении его свойств в кристаллическом состоянии, за что и назван Fc-фрагментом (Fragment cristalline). В дальнейшем было показано, что Fc-фрагмент взаимодействует с мембранами клеток, выполняя транспортную функцию, фиксацию Cql компонента комплемента и т. д.
Все иммуноглобулины — это тетрамеры, состоящие из четырех полипептидных цепей. Две из них представлены длинными (около 450 аминокислотных остатков), или тяжелыми (heavy), Н-цепями, а две другие — короткими (около 220 аминокислотных остатков), или легкими (light), L-цепями. Легкие цепи являются общими для всех классов и подклассов иммуноглобулинов и могут произвольно сочетаться с любой тяжелой цепью. У большинства позвоночных легкие цепи разделяются по антигенным свойствам на два типа — «каппа» (с-тип) и «лямбда» (1-тип).
Изучение первичной структуры полипептидных цепей иммуноглобулинов показало, что N-концевые участки тяжелых и легких цепей, включающие около 100 аминокислотных остатков, обладают уникальной структурой и аминокислотной последовательностью. Они представляют собой вариабельные области (V-область) тяжелых (VH) и легких (VL) цепей. Указанные вариабельные области, с одной стороны, образуют антигенсвязывающие центры антител, а с другой — определяют их многообразие. Остальная (С-концевая) последовательность тяжелой и легкой цепей идентична у всех молекул данного класса или подкласса, но различна у молекул, относящихся к разным классам и подклассам. Она носит название константная область (С-область). В зависимости от структуры константной области тяжелых цепей молекулы иммуноглобулинов делят на классы. В настоящее время известно пять классов иммуноглобулинов, обозначаемые как IgA, IgM, IgG, IgD и IgE. Тяжелые цепи иммуноглобулинов каждого класса различаются по своим фи-шко-химическим, антигенным и иммунологическим свойствам. Эти цепи обозначаются греческими буквами в соответствии с латинским обозначением класса иммуноглобулинов: IgA (а-цепь), IgM (m-цепь), IgG (g-цепь), IgD (d-цепь) и IgE (е-цепь).
В N-концевой части Н- и L-цепей иммуноглобулинов имеются участки, отличающиеся чрезвычайно высокой вариабельностью (гипервариабельные участки): HI; Н2; НЗ; LI; L2; L3. Каждый из них содержит около шести аминокислотных остатков. Вместе эти участки образуют антигенсвязывающий центр.
Цепи иммуноглобулинов состоят из доменов — структурных единиц, содержащих около 110 остатков аминокислот. Тяжелые цепи образуют четыре домена: один вариабельный и три константных, обозначаемые Сн1; Сц2; СцЗ. Легкие цепи содержат но два домена — вариабельному (VL) и константному (Q,). Каждый домен представляет собой плотно упакованную глобулу, так как аминокислотные последовательности обладают определенным
158
159
 сходством
друг с другом. И эти участки полипептидной
цепи замыкаются
внутрицепочной дисульфидной связью.
сходством
друг с другом. И эти участки полипептидной
цепи замыкаются
внутрицепочной дисульфидной связью.
Каждый из Fab-фрагментов состоит из одной L-цепи (VL- и CL-домены) и половины одной Н-цепи (VH- и Сн-Домены), а Fc-фрагмент образован остатками двух Н-цепей, включающих Сн2 и Сн3 домены.
Классы иммуноглобулинов различаются по своим химическим и биологическим свойствам. Так, их различная скорость полимеризации выражается в том, что /gG существуют в виде мономера с молекулярной массой 160 000, тогда как IgA состоит из одной или двух, а IgM, как правило, из пяти соответствующих субъединиц.
Биологические и иммунологические различия между классами иммуноглобулинов имеют большое практическое значение, так как они обусловливают характер реакции, следующей за образованием комплекса антиген — антитело.
Защитное действие антител может выражаться в прямом повреждении микроорганизмов или в нейтрализации синтезируемого ими токсина. Нейтрализация токсина состоит в прямой блокаде токсофорной группы антителами (антигенные и токсинные детерминанты идентичны). Однако связывание токсина и антитела может вызывать и пространственные изменения конфигурации, которые делают невозможной адсорбцию токсина на субстрате — клетке, чувствительной к токсину.
Иммуноглобулины класса G оказывают сильное нейтрализующее действие на токсины и вирусы, а также способны к преципитации, обладают опсонизирующим действием (опсонины — греч. Opsonion — снабжение пищей — антитела, в присутствии комплемента стимулирующие поглощение чужеродных частиц, бактерий, вирусов и их разрушение лейкоцитами), усиливая фагоцитоз. При умеренном нагревании IgG может связываться с антителом, т. е. начинается реакция, названная связыванием комплемента, ответственность за которую несет Fc-фрагмент. При этом кроме непосредственной нейтрализации вирусов и токсинов IgG способствуют также зависящему от комплемента фагоцитозу и внутриклеточной инактивации микроорганизмов. На долю IgG приходится около 80 % всех иммуноглобулинов.
Более сложной, чем при нейтрализации токсинов, представляется роль антител в разрушении и устранении самого возбудителя. У некоторых грамотрицательных бактерий антитела в связи с неспецифически реагирующими факторами комплемента сыворотки могут вызывать бактериолиз. Антитела и комплемент, однако, не вызывают цитолиз непосредственно, а лишь изменяют вначале поверхность бактериальной клетки таким образом, что она становится доступной действию имеющегося в организме фермента лизоцима. Лизоцим реагирует с мурамилпептидом клеточной стенки и вызывает разрыв в одном или нескольких местах поверхности. Повышение давления внутри клетки, дохо-
дящее до 20 ати, приводит к тому, что микроорганизм с поврежденной стенкой лопается.
Другой путь возможного действия антител — опсонизация заключается в изменении поверхности микробной клетки таким образом, что она становится более удобной для поглощения ее фагоцитами. Как и бактериолиз, опсонизация протекает на фоне активации комплемента, вызванной реакцией антиген — антитело. В отличие от цитолиза, требующего для своего осуществления присутствия на бактериальной клетке всех девяти факторов комплемента, в опсонизации участвуют только четыре компонента комплемента Q...C4.
Особенно выражено опсонизирующее действие антител при колиинфекции новорожденных домашних животных. Большое значение имеют опсонизирующие антитела и для защиты против диплококков и стрептококков. Гладкая поверхность капсулы у диплококков мешает их поглощению фагоцитами. Лишь когда под действием антител их поверхность меняется, т. е. становится шероховатой, они могут быть фагоцитированы и затем уничтожены внутри клетки. Стрептококки поддаются фагоцитозу даже при отсутствии специфических антител, но из-за присутствия особого белка, названного М-антигеном, инактивируются не полностью. Часть их снова выходит из фагоцитов и продолжает размножаться дальше. Антитела, направленные против М-антигена патогенного типа стрептококков, способствуют внутриклеточной инактивации этих микроорганизмов.

Ведущее место в реакциях бактериолиза и опсонизации принадлежит IgM. Этот класс иммуноглобулинов является самым «древним» в филогенетическом отношении. В ходе иммунного ответа вначале также появляются антитела /gM-клас-са. У новорожденных первые антитела принадлежат к IgM. В сыворотке молекулы IgM существуют в виде пентамера с молекулярной массой 950000. Пять мономерных субъединиц расположены радиально, причем Fc-фрагменты направлены к центру круга, а Fab-фрагменты — кнаружи (рис. 4.6).
Поскольку IgM в полной мере не способны к нейтрализации
токсинов, то животные раннего p„c 4.6. Строение пентамерной структу- постнатального периода наибо- ры иммуноглобулина м
160
11 — 3389
161
лее подвержены токсикоинфекциям. IgM составляют примерно 3...10 % иммуноглобулинов сыворотки крови.
Характерная особенность структуры IgM определяется тем, что она призвана оказывать особое защитное действие против микроорганизмов и других крупных антигенов, имеющих на своей поверхности антигенную мозаику из повторяющихся детерминантов. Антитела IgM связывают соответствующий антиген каждым из своих пяти участков связывания. Такие повторы антигенных детерминантов характерны для О-антигенов из клеточной стенки грамот-рицательных бактерий, жгутиков бактерий и вирусов, имеющих капсиды. Даже если каждый отдельный участок связывания проявляет лишь небольшую авидность, общая авидность всей молекулы повышается из-за суммирования нескольких таких связей.
Если антитела IgM реагируют таким образом с антигеном, то при нахождении антигена близко к поверхности клетки комплемент настолько активируется, что вызывает локализованное повреждение нижележащей клеточной мембраны. Так, единственная молекула IgM в силу активирования комплемента может вызвать лизис клетки (например, бактерии или эритроцита). Антитела класса IgG, напротив, могут вызвать клеточный лизис путем активирования комплемента только в том случае, когда две молекулы антитела вступают в реакцию на поверхности клетки очень близко друг от друга, но для этого необходимо очень много (тысячи) молекул IgG.
Если антиген не связан с поверхностью клетки, а существует в свободном виде с множеством детерминантов, то антитела IgM не имеют никаких преимуществ перед IgG- Напротив, их участки связывания, характеризующиеся низкой авидностью, не могут все связываться с одной и той же молекулой антитела и легко диссоциируют. Поэтому антитела IgG более эффективны при нейтрализации бактериальных токсинов и при защите клеток от адсорбирования на них вируса.
Сравнение активности антител IgG и IgM по отношению к одному и тому же поверхностному антигену сальмонелл показало, что на основе соотношения масс последние в 20 раз активнее при агглютинации [лат. agglutinatio — склеивание в глыбки (комочки) микробов, эритроцитов или других клеток и выпадение их в осадок в присутствии электролитов] сальмонелл, более чем в 100 раз активнее в инактивации микробной клетки с участием комплемента и более чем в 1000 раз эффективнее в опсонизации микроорганизмов и других клеток.
Сывороточные антитела IgA в отличие от IgM и IgG не способны к связыванию комплемента и поэтому не могут вызывать ни иммуноприлипания, ни цитолиза или конглютинации. Считают, что этому классу иммуноглобулинов принадлежит функция защиты организма от проникновения возбудителя и развития инфекции. Этот класс иммуноглобулинов участвует в элиминации пи-
щевых и других чужеродных антигенов, которые могут проникнуть в организм через слизистые оболочки, а также в регуляции иммунного ответа на эти антигены.
Иммуноглобулины А составляют лишь 10...15 % всех иммуноглобулинов сыворотки. Однако они преобладают в экстра-васкулярных секретах. Большая часть IgA в слюне, слезах, пищеварительных соках, секретах слизистой носа находится в виде секреторного IgA (SIgA), т. е. полимерной формы, состоящей из двух /gA-мономеров, соединяющей молекулы гликопротеина, называемого секреторным компонентом. Биологическая роль секреторного компонента сводится к повышению устойчивости IgA от разрушения протеолитическими ферментами (рис. 4.7).

Рис. 4.7. Схема строения секреторного иммуноглобулина А
Иммуноглобулин ыЕ — это мономеры, содержание которых в сыворотке крови ничтожно мало — 0,00005...0,0003 г/л, или 0,002 % общего количества Ig. За сутки их синтезируется 0,02 мг/кг; период полураспада в сыворотке крови составляет 2...3 сут, а в коже — 9...14сут. К классу IgE относится основная масса аллергических антител-реагинов. Уровень их значительно повышается у организмов, страдающих аллергией и зараженных гельминтами. IgE связываются с Fc-рецепторами тучных клеток и базофилов. При контакте с аллергеном образуются мостики IgE — антиген — IgE, что сопровождается поступлением ионов кальция в клетку-мишень, активацией в ней биохимических процессов и выделением биологически активных веществ, вызывающих аллергические реакции немедленного типа. Эозинофильный хемотаксический фактор, выделяемый тучными клетками, способствует аккумуляции
162
163
эозинофилов и деструкции гельминтов. Предполагается также, что IgE, покрывая паразита, аккумулирует макрофаги благодаря Fc-рецепторам этих клеток.
Иммуноглобулины D — это мономеры; их содержание в крови составляет 0,03...0,04 г/л, или до 1 % общего количества иммуноглобулинов. В сутки их синтезируется от 1 до 5 мг/кг, а период полураспада колеблется в пределах 2...8 сут. IgD участвуют в развитии местного иммунитета, обладают антивирусной активностью, в редких случаях активируют комплемент. Плазматические клетки, секретирующие IgD, локализуются преимущественно в миндалинах и аденоидной ткани. IgD выявляются на В-клетках, отсутствуют на моноцитах, нейтрофилах и Т-лимфоцитах. Полагают, что IgD участвуют в дифференцировке В-клеток, способствуют развитию антиидиотипического ответа, участвуют в аутоиммунных процессах.
Основная масса IgM и IgD находится в плазме, a IgG и IgA распределяются примерно в одинаковых соотношениях между плазмой и межсосудистой тканью.
