
- •1.1Предмет и задачи атомной физики, её место среди других физических наук.
- •1.2Сериальные закономерности в атомных спектрах, комбинационный принцип Ритца, термы.
- •1.3Класическая модель атома Томсана.
- •1.4Основы классической теории электромагнитного излучения.
- •2.1Опыты Резерфорда.
- •2.2Вывод формулы Резерфорда для рассеяния α-частиц.
- •2.3Следствия из опытов Резерфорда.
- •2.4Экспериментальное определение заряда ядра по методу Чедвика.
- •2.5Планетарная модель атома Резерфорда.
- •2.6Столкновение частиц
- •2.7Сечение рассеяния
- •3.1Теория Бора для атома водорода, круговые орбиты.
- •3.2Доказательство существования дискретной структуры энергетических уровней атомов.
- •3.3Опыты Франка и Герца
- •3.4Изотопический сдвиг
- •5.1Корпускулярно волновой дуализм
- •5.2Гипотеза де Бройля и ее экспериментальное подтверждение на примере дифракции электронов, атомов, нейтронов
- •5.3Фазовая и групповая скорости волн де Бройля.
- •5.4Волновой пакет. Статистический характер связи корпускулярных и волновых свойств.
- •5.5Электронный микроскоп, понятие об электронной оптике.
- •6.1Основы квантовой механики.
- •6.2Соотношение неопределённостей.
- •6.3Волновая функция.
- •6.4Принцип суперпозиции.
- •6.5Уравнение Клейна-Гордона.
- •7.1Нестационарное и стационарное уравнение Шрёдингера.
- •7.2Частица в потенциальном ящике.
- •8.1Уравнение Шредингера для атома водорода
- •8.2Физический смысл квантовых чисел
- •9.1Спектры атомов щелочных металлов.
- •9.2Серии в спектрах щелочных металлов и их происхождение.
- •9.3Закон Мозли
- •9.4Тонкая структура Спектральных линий атомов щелочных металлов.
- •9.5Спин Электрона
- •10 Тема
- •10.1Принцип Паули и заполнение электронных оболочек атомов
- •10.2Физические основы периодической системы элементов таблицы Менделеева
- •11 Тема
- •11.1Магнитные свойства Атомов
- •11.2Орбитальный и собственный момент электрона
- •11.3Полный магнитный момент одноэлектронного атома
- •11.4Гиромагнитное отношение орбитальных моментов
- •11.5Магнитная энергия атомов
- •11.6Опыты Штерна и Герлаха
- •12 Тема
- •13 Тема
- •13.1Рентгеновские лучи.
- •13.2Тормозное и характеристическое излучения.
- •13.3Серии в спектре характеристического излучения и его особенности.
- •13.4Прохождение рентгеновских лучей через вещество.
- •14 Тема
- •14.1Принцип построения оптических квантовых генераторов.
8.2Физический смысл квантовых чисел
До середины ХIХ века атом считался мельчайшей и неделимой частицей материи. Открытие электрона и радиоактивности доказали сложность строения атома. Электрон был открыт в 1897 г. английским ученым Дж. Дж. Томсоном; название было дано в 1891 г. англичанином Дж. Стони. Заряд и масса были определены в 1909 г. Р. Малликеном. Заряд электрона принят в настоящее время за единицу отрицательного электричества.
В 1926 г. Э.Шредингер предложил для описания движения электрона в атоме волновое уравнение, получившее название уравнения Шредингера. Решением уравнения Шредингера является волновая функция ψ, называемая также орбиталью. Волновая функция может иметь как действительные, так и мнимые решения. Поэтому, физический смысл имеет только |ψ|2 , который характеризует вероятность нахождения электрона в данном объеме пространства. Термином орбиталь обозначают также область пространства, в которой наиболее вероятно нахождение электрона. Решение уравнения Шредингера определяется набором четырех чисел, получивших название квантовых чисел.
Главное квантовое число n характеризует энергию электронной орбитали. Главное квантовое число принимает значения 1, 2, 3, 4, 5, 6, 7…∞, обозначаемые также буквами K, L, M, N , O, P, Q … Чем больше n, тем выше энергия орбитали. Переходы электронов с одной орбитали на другую сопровождается излучением или поглощением квантов энергии.
Главное квантовое число характеризует также удаленность максимума электронной плотности от ядра. Чем больше n, тем больше объем орбитали. Совокупность электронов с одинаковым значением n называют энергетическим уровнем или оболочкой, слоем.
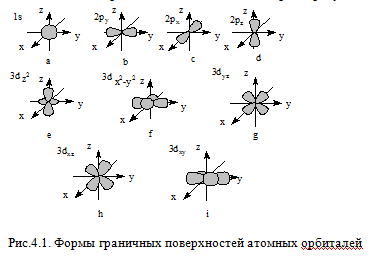
Орбитальное (побочное, азимутальное) квантовое число l принимает значения от 0 до (n-1) и характеризует форму граничной поверхности атомной орбитали. Обозначения: 0-s; 1-p; 2-d; 3-f и т.д. Совокупность электронов, имеющих одинаковые значения l и n, называют энергетическим подуровнем (подоболочкой). Граничная поверхность s-орбиталей имеет форму сферы (рис.4.1,а), р-орбиталей – гантели (рис.4.1,b-d). Граничные поверхности d-орбиталей показаны на рис.4.1,e-i. Форма граничных поверхностей f-орбиталей сложнее, чем d-орбиталей.
Орбитальное квантовое число характеризует также энергию электронов подуровня в пределах данного энергетического уровня.
Энергия подуровней возрастает в ряду s, p, d, f (Es<Ep<Ed<Ef).
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве и может принимать целочисленные значения от +l до –l, включая 0. d-подуровень содержит пять орбиталей, s-подуровень – одну (рис.4.1,a), p-подуровень – три (рис.4.1,b-d), а f-подуровень – семь орбиталей.
Атомной орбиталью называют также волновую функцию, характеризуемую определенным набором трех квантовых чисел
Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси и может принимать два значения - +1/2 и -1/2.
Состояние электрона в атоме полностью характеризуется с помощью четырех квантовых чисел n, l, ml
9 Тема
