
- •Часть I
- •Часть I. Механика. Молекулярная физика и термодинамика
- •1.1. Основные понятия кинематики
- •1.2. Скорость
- •1.3. Неравномерное движение. Ускорение
- •1.4. Кинематические уравнения
- •1.4.1. Равномерное прямолинейное движение
- •1.4.2. Равнопеременное движение
- •1.5. Кинематика вращательного движения
- •1.6. Связь между линейными и угловыми величинами
- •Динамика материальной точки.
- •Первый закон Ньютона. Инерциальные системы отсчета
- •2.2. Сила и масса. Второй и третий законы Ньютона
- •2.3. Закон сохранения импульса. Центр масс системы
- •2.4. Силы в механике
- •2.4.1. Закон всемирного тяготения. Сила тяжести
- •2.4.3. Силы упругости
- •Работа. Мощность. Механическая энергия
- •3.2. Консервативные и диссипативные силы
- •3.3. Кинетическая и потенциальная энергия
- •3.4. Закон сохранения энергии
- •3.5. Применение законов сохранения энергии и импульса к соударению абсолютно упругих и неупругих тел
- •2.4.2. Силы трения
- •Кинематика и динамика твердого тела
- •Момент инерции
- •4.2. Кинетическая энергия вращающегося твердого тела
- •4.3. Момент силы. Уравнение динамики вращательного движения твердого тела
- •4.4. Момент импульса и закон его сохранения
- •4.5. Свободные оси. Гироскопы
- •4.6. Сопоставление формул кинематики и динамики поступательного и вращательного движений
- •Элементы механики жидкостей.
- •Пространственно-временные соотношения и их следствия. Понятие о релятивистской механике.
- •Общие сведения о колебаниях. Одномерный классический гармонический осциллятор
- •Пружинный маятник (рис. 3)
- •Физический маятник (рис. 4)
- •Математический маятник (рис. 5)
- •Затухающие колебания.
- •Гармонический осциллятор при наличии сил сопротивления
- •Вынужденные колебания
- •Сложение колебаний.
- •Векторная диаграмма
- •Сложение взаимно перпендикулярных колебаний
- •Разность фаз . В этом случае уравнение (25) примет вид ,
- •Качественные методы теории колебаний
- •Автоколебания. Параметрический резонанс
- •Свободные электрические колебания в контуре без активного сопротивления
- •Затухающие электрические колебания
- •Волны в упругой среде.
- •Упругие волны
- •Уравнение бегущей волны
- •Принцип суперпозиции. Интерференция волн
- •1) Если колебания происходят в одинаковой фазе, т.Е. ( , (116)
- •Стоячие волны
- •Звуковые волны
- •Физические основы молекулярно-кинетической теории газов
- •1. Молекулярно-кинетическая теория идеальных газов
- •Основные положения молекулярно-кинетической теории
- •1.2. Масса и размеры молекул. Количество вещества
- •1.3. Законы идеального газа
- •1.4. Уравнение состояния идеального газа
- •1.5. Основное уравнение молекулярно-кинетической теории идеальных газов
- •Физические основы молекулярно-кинетической теории газов
- •Закон Максвелла о распределении молекул по скоростям
- •1.7. Распределение Больцмана
- •Явления переноса в термодинамически неравновесных системах.
- •Средняя длина свободного пробега молекул. Явления переноса
- •Физические основы термодинамики.
- •Внутренняя энергия системы. Степени свободы молекул
- •2.2. Первое начало термодинамики. Удельная и молярная теплоемкости
- •2.3. Работа газа по перемещению поршня. Теплоемкость при постоянном объеме и давлении
- •2.4. Применение первого начала термодинамики к изопроцессам. Адиабатный процесс. Политропный процесс
- •2.5. Круговой процесс. Обратимые и необратимые процессы
- •Кпд кругового процесса
- •2.6. Энтропия
- •Статистическое толкование энтропии
- •2.7. Второе и третье начала термодинамики
- •2.8. Тепловые двигатели и холодильные машины
- •Теорема Карно
- •Реальные газы
- •Уравнение Ван-дер-Ваальса
- •Внутренняя энергия реального газа
- •4. Свойства жидкостей
- •4.1 Особенности жидкого состояния вещества
- •4.2. Энергия поверхностного слоя и поверхностное натяжение жидкостей
- •4.3 Смачивание и несмачивание
- •4.4. Капиллярные явления
1.5. Основное уравнение молекулярно-кинетической теории идеальных газов
Важной задачей МКТ является установление связи между микроскопическими параметрами газа (массой, скоростью, импульсом, кинетической энергией молекул) и его макроскопическими параметрами (температурой, давлением и объемом). Эту взаимосвязь устанавливает основное уравнение МКТ.
Рассмотрим
идеальный газ, который в объеме
содержит
![]() молекул, движущихся со скоростями
молекул, движущихся со скоростями
![]() .
Введем среднюю
квадратичную скорость
.
Введем среднюю
квадратичную скорость
 , (20)
, (20)
которая характеризует всю совокупность молекул газа.
Основное уравнение молекулярно-кинетической теории идеальных газов имеет вид:
![]() .
(21)
.
(21)
Тепловое движение молекул характеризуется средней кинетической энергией молекулы
![]() . (22)
. (22)
Тогда уравнение (21) с учетом (22) примет вид:
![]() . (23)
. (23)
Если
вместо концентрации молекул
![]() использовать выражение
использовать выражение
![]() ,
где
‑ плотность газа, то уравнение (21)
примет вид:
,
где
‑ плотность газа, то уравнение (21)
примет вид:
![]() . (24)
. (24)
Если
вместо концентрации молекул
![]() использовать выражение
использовать выражение
![]() ,
то уравнение (23) примет вид:
,
то уравнение (23) примет вид:
![]() .
.
Далее,
произведение
![]() можно представить в виде:
можно представить в виде:
![]() .
.
где
![]() ‑ кинетическая энергия всех молекул
газа. В этом случае уравнение (23) перепишем
как:
‑ кинетическая энергия всех молекул
газа. В этом случае уравнение (23) перепишем
как:
![]() .
.
Сравнив это уравнение с уравнением Менделеева-Клапейрона, можно записать:
![]() . (25)
. (25)
То есть общая кинетическая энергия всех молекул прямо пропорциональна температуре.
Преобразуем
выражение для средней энергии одной
молекулы
![]() следующим образом:
следующим образом:
 ,
или
,
или
![]() .
(26)
.
(26)
Исходя из выражения (26), можно найти среднюю квадратичную скорость молекул:
![]() . (27)
. (27)
Из уравнения (26) следует, что термодинамическая температура является количественной мерой энергии поступательного движения молекул идеального газа.
При одинаковой температуре средние кинетические энергии молекул всех газов одинаковы, несмотря на различие масс молекул разных газов.
При
температуре абсолютного нуля в случае
идеального газа согласно выражению
(26) средняя кинетическая энергия молекулы
![]() .
То есть при
.
То есть при
![]() прекращается поступательное движение
молекул газа, а следовательно, его
давление равно нулю. Но это не означает,
что при абсолютном нуле температуры
прекращается всякое движение вообще.
Ведь при этом остается движение электронов
в атоме, нуклонов в ядре, движение
элементарных частиц и так далее.
прекращается поступательное движение
молекул газа, а следовательно, его
давление равно нулю. Но это не означает,
что при абсолютном нуле температуры
прекращается всякое движение вообще.
Ведь при этом остается движение электронов
в атоме, нуклонов в ядре, движение
элементарных частиц и так далее.
Лекция 15 (2 часа)
Физические основы молекулярно-кинетической теории газов
(Распределение молекул по скоростям. Экспериментальная проверка распределения Максвелла. Барометрическая формула. Распределение Больцмана. Опыты Перрена. Средняя длина свободного пробега молекул. Число столкновений. Зависимость средней длины свободного пробега от концентрации и эффективного диаметра молекул)
Закон Максвелла о распределении молекул по скоростям
Если газ находится в равновесии, молекулы движутся хаотически, и все направления их движения равновероятны. Скорости молекул могут быть самыми различными по модулю и при каждом соударении с другими молекулами изменяются случайным образом.
В газе, находящемся в состоянии равновесия, устанавливается стационарное распределение молекул по скоростям, подчиняющееся определенному статистическому закону. Этот закон был выведен теоретически Дж. Максвеллом. Максвелл предполагал, что вещество состоит из очень большого числа тождественных молекул, находящихся в состоянии беспорядочного теплового движения при одинаковой температуре. Также предполагалось, что силовые поля на газ не действуют.
Закон
Максвелла описывается некоторой функцией
![]() ,
называемой функцией
распределения молекул по модулям
скоростей.
Если разбить диапазон скоростей молекул
на малые интервалы, равные
,
называемой функцией
распределения молекул по модулям
скоростей.
Если разбить диапазон скоростей молекул
на малые интервалы, равные
![]() ,
то на каждый интервал скорости будет
приходиться некоторое число молекул
,
то на каждый интервал скорости будет
приходиться некоторое число молекул
![]() ,
скорости которых заключены в этом
интервале.
,
скорости которых заключены в этом
интервале.
Функция
определяет
относительное число молекул
![]() ,
скорости которых лежат в интервале от
,
скорости которых лежат в интервале от
![]() до
до
![]() ,
то есть
,
то есть
![]() ,
откуда
,
откуда
![]() .
(28)
.
(28)
Применяя методы теории вероятностей, Дж. Максвелл нашел вид функции распределения молекул идеального газа по модулям скоростей хаотического движения:
 . (29)
. (29)
Из (29) следует, что конкретное распределение зависит от рода газа (от массы молекулы ) и от его термодинамической температуры. Очевидно, что функция распределения не зависит ни от давления, ни от объема газа. График функции распределения имеет вид, показанный на рис. 5.
В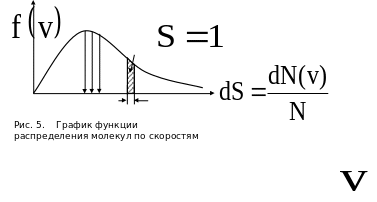 ыражение
представляет собой вероятность встретить
молекулу со скоростью, принадлежащей
интервалу
ыражение
представляет собой вероятность встретить
молекулу со скоростью, принадлежащей
интервалу
![]() .
Эта вероятность равна площади
заштрихованной полоски с основанием
(рис. 5). Относительная доля молекул,
имеющих определенную скорость, равна
нулю.
.
Эта вероятность равна площади
заштрихованной полоски с основанием
(рис. 5). Относительная доля молекул,
имеющих определенную скорость, равна
нулю.
Площадь
под кривой
![]() равна вероятности достоверного события
– встретить молекулу со скоростью,
принадлежащей интервалу
равна вероятности достоверного события
– встретить молекулу со скоростью,
принадлежащей интервалу
![]() ,
то есть равна единице. Это означает, что
функция
удовлетворяет условию
нормировки:
,
то есть равна единице. Это означает, что
функция
удовлетворяет условию
нормировки:
![]() (30)
(30)
Наиболее
вероятная
![]() ,
средняя арифметическая
,
средняя арифметическая
![]() и
и
среднеквадратичная
![]() скорости молекул
скорости молекул
Наиболее
вероятная скорость соответствует
максимуму функции распределения, ведь
именно этой скоростью будет обладать
наибольшее число
молекул.
Ее
значение
найдется
из
условия
экстремума
функции
![]() :
:
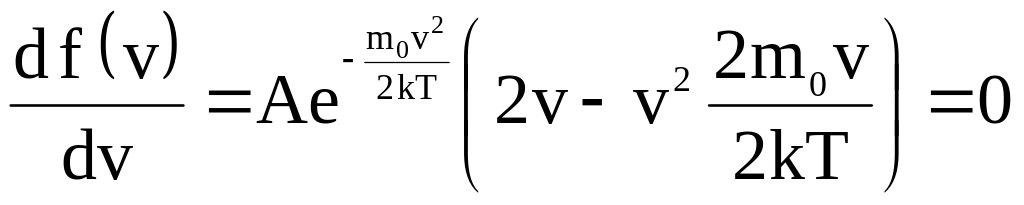 .
.
![]() .
(31)
.
(31)
О тсюда
видно, что при увеличении температуры
максимум кривой распределения сместится
вправо, так как при увеличении
увеличивается
тсюда
видно, что при увеличении температуры
максимум кривой распределения сместится
вправо, так как при увеличении
увеличивается
![]() ,
которая определяет положение максимума.
Но площадь под кривой должна оставаться
постоянной. Поэтому величина максимума
будет уменьшаться. Влияние же массы
молекулы
,
которая определяет положение максимума.
Но площадь под кривой должна оставаться
постоянной. Поэтому величина максимума
будет уменьшаться. Влияние же массы
молекулы
![]() будет обратным. Влияние температуры и
массы молекулы на вид функции распределения
показано на рис. 6.
будет обратным. Влияние температуры и
массы молекулы на вид функции распределения
показано на рис. 6.
Выражение для средней скорости определяется по формуле
![]() .
(32)
.
(32)
Аналогично найдем выражение для среднеквадратичной скорости:
![]() .
.
Произведя интегрирование, получим:
![]() .
(33)
.
(33)
Из сравнения найденных скоростей вытекает:
![]() .
.
Соотношения между скоростями:
![]()
При
комнатной температуре
![]() средняя арифметическая скорость молекул
кислорода будет равна:
средняя арифметическая скорость молекул
кислорода будет равна:
![]() .
.
Первое экспериментальное определение скоростей молекул было осуществлено Штерном в 1920 г: подтвердилась правильность оценки средней скорости молекул, вытекающей из распределения Максвелла; о характере распределения этот опыт дал лишь приближенные сведения. Более точно закон Максвелла был проверен в опыте Ламмерта (1929 г.).
Из функции распределения молекул по модулям скоростей можно получить функцию распределения молекул по кинетическим энергиям теплового движения:
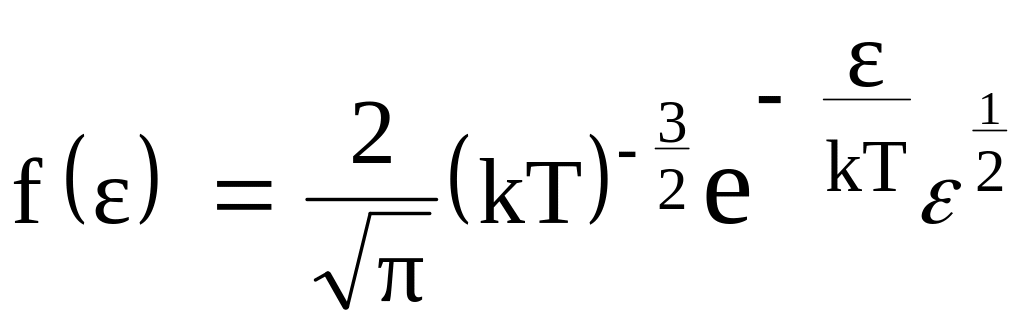 . (34)
. (34)
Найдем
среднюю кинетическую энергию
![]() молекулы идеального газа:
молекулы идеального газа:
 (35)
(35)
