
- •2.Основные законы химии. Закон сохранения массы. Закон постоянства состава.
- •3) Периодический закон и Периодическая система элементов д.И.Менделеева. Структура Периодической системы элементов.
- •4) Строение атома. Квантовые числа. Порядок заполнения электронных подуровней в атоме.
- •5) Общие представления о химической связи. Химическая связь и валентность.
- •6) Химическая связь. Типы химической связи. Ионная связь.
- •Характерные свойства металлов
- •12) Растворимость. Способы выражения состава раствора.
- •13) Общие свойства растворов не электролитов.
- •2) Температура кипения и кристаллизации разбавленных растворов.
- •16) Устойчивость дисперсных систем. Факторы, влияющие на различные типы устойчивости.
- •17) Адгезия, когезия. Механизм возникновение. Работа адгезии и когезии.
- •Энтропия системы. II начало термодинамики
- •Энергия Гиббса как критерий самопроизвольного протекания химических процессов
- •22) Диаграммы плавкости двухкомпонентных систем.
- •23) Окислительно-восстановительные процессы. Процессы окисления и восстановления овр. Метод электронного баланса.
- •Классификация окислительно-восстановительных реакций.
- •Уравнение Нернста.
- •29) Законы Фарадея. Выход по току.
- •Зонная плавка органического самогона
- •44) Коррозия. Коррозия в растворах неэлектролитов. Ингибиторы коррозии.
- •45) Газовая коррозия. Электрохимическая коррозия.
Характерные свойства металлов
Металлическая связь — химическая связь, обусловленная свободными электронами. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Зонная теория твёрдого тела — квантовомеханическая теория движения электронов в твёрдом теле. 9. Металлы вещества, обладающие в обычных условиях характерными, металлическими, свойствами-высокими электрической проводимостью и теплопроводностью. отрицательным температурным коэффициентом электрической проводимости, способностью хорошо отражать световые волны (блеск), пластичностью. К металлы относятся как собственно металлы (простые вещества), так и их сплавы, металлические соединения. В металлах существует металлическая связь, характеризующаяся тем, что кристаллическая решетка образована положительными ионами, тогда как валентные электроны делокализованы по всему пространству решетки. Классификация металловВсе металлы делятся на четыре группы: s-металлы (все s-элементы, кроме Н и Не), р-металлы (элементы грeggs IIIа, кроме В, а также Sn, Рb, Sb, Bi, Ро), d-M. и f-металлы.
10.Межмолекулярные взаимодействия, взаимодействия молекул между собой, не приводящее к разрыву или образованию новых химических связей. Межмолекулярные взаимодействия определяют отличие реальных газов от идеальных, существование жидкостей и молекулярных кристаллов. От межмолекулярных взаимодействий зависят многие структурные, спектральные, термодинамические, теплофизические и другие свойства веществ. Появление понятия межмолекулярные взаимодействия связано с именем Й. Д. Ван-дер-Ваальса, который для объяснения свойств реальных газов и жидкостей предложил в 1873 уравнение состояния, учитывающее межмолекулярные взаимодействия. Поэтому силы межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми. Виды межмолекулярных взаимодействий. Основу межмолекулярных взаимодействий составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. В экспериментально определяемых свойствах вещества проявляется усредненное взаимодействие, которое зависит от расстояния R между молекулами, их взаимной ориентации, строения и физических характеристик (дипольного момента, поляризуемости и др.). При больших R, значительно превосходящих линейные размеры l самих молекул, вследствие чего электронные оболочки молекул не перекрываются, силы межмолекулярного взаимодействия можно достаточно обоснованно подразделить на три вида - электростатические, поляризационные (индукционные) и дисперсионные. Электростатические силы иногда называют ориентационными, однако это неточно, поскольку взаимная ориентация молекул может обусловливаться также и поляризационными силами, если молекулы анизотропны.Проявление сил отталкивания – малая сжимаемость жидкости.
Соотношение сил когезии и адгезии и сил теплового движения молекул определяет агрегатное состояние вещества.
Силы
столкновения: проявляют себя на очень
малых расстояниях и обычно убывают с
увеличением расстояния. Их можно
определить в качестве исходного
коэффициента.
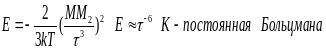
11) Строение реальных кристаллов. Дефекты кристаллов. Монокристаллы.
Молекулярные кристаллы:

В молекулярных узлах решетки находится молекула. Между узлам такой решетки будет молекулярная связь (силы Вандервальса).
Силы Вандервальса:
Энергия: 0.4 - 4.2 кДж/моль так как эта энергия мала – кристаллы обладают:
-большой летучестью
-низкой температурой плавления.
-диэлектрики.
Плотность упаковки определяет хим. связи внутри молекулы. Для молекулярных кристаллов применимы все стеклометрические законы.
Атомные кристаллы с металлической связью (атомные металлические решетки)
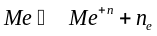 .
.
Металлы реализуют металлическую связь, в силу металлической связи кристаллы обладают:
- хорошей теплопроводностью
хорошие проводники
Атомные кристаллы с ковалентной связью: графит, алмаз, и тд.
В плоских решетках между узлами суммируется ковалентная связь:
-направленная
-насыщенная
За счет ковалентной связи кристаллы обладают:
невысокое координационное число
высокие температуры плавления
большая твердость
диэлектрики, полупроводники
электронная проводимость
энергия кристаллической решетки велика (она определяется прочностью ковалентной связи)
Ионные кристаллы:
NaCl, CsCl
В узлах – ионы, между которыми кулоновские взаимодействия.
Ионная связь: ненаправленная, ненасыщенная
Кристалл – как одна большая молекула.
За счет ионной связи кристаллы обладают:
малая твердость
диэлектрики, полупроводники
высокая температура плавления
Реальные кристаллы: дефект кристаллов – нарушение дальнего порядка кристаллической решетки.
Для реальных кристаллов всегда имеет место дефект.
Дефект кристаллической решетки появляется:
тепловое воздействие на кристалл
возможно внедрение в решетку примесей
механическое напряжение в кристалле
Дефекты:
точечные дефекты – это нарушение в 1-2 узла или междоузлие в расчете на 1 элементарную ячейку.
