
- •Глава II коррозия металлов
- •§ 1. Определение и методы исследования коррозии.
- •1.1 Классификация
- •Методы оценки коррозии.
- •Методы коррозионных исследований
- •§2. Химическая коррозия Внешние факторы газовой коррозии.
- •Окисные пленки.
- •Коррозия в неэлектролитах.
- •§ 3. Электрохимическая коррозия Причины возникновения коррозии
- •Коррозия с водородной и кислородной деполяризацией
- •Влияние внутренних факторов на скорость коррозии
- •Атмосферная коррозия
- •Морская коррозия
- •Подземная коррозия
- •Электрокоррозия
- •§ 4. Методы защиты от электрохимической коррозии
- •Обработка коррозионной среды
- •Катодная защита
- •Протекторная защита
- •Анодная защита
- •§ 4. Диаграммы потенциал – рН (диаграммы Пурбэ)
Коррозия с водородной и кислородной деполяризацией
Коррозию принято называть коррозией с водородной деполяризацией или коррозией с кислородной деполяризацией в зависимости от того, является ли катодной реакцией восстановление ионов водорода или восстановление молекулярного кислорода. Это два основных и наиболее вероятных типа электрохимической коррозии, поскольку водный электролит всегда содержит те или иные количества как водородных ионов, так и растворенного кислорода воздуха. Если обе катодные реакции идут параллельно с соизмеримой скоростью, то говорят о коррозии со смешанной деполяризацией. Коррозионный процесс с иными катодными реакциями, например с приведенными на стр. 56, встречается гораздо реже и специального названия не имеет.
Термодинамическая возможность протекания того или иного типа коррозии, как уже отмечалось, определяется соотношением
равновесных потенциалов электродных реакций. Из уравнения Нернста вытекает, что равновесные потенциалы каждой из реакций при комнатной температуре выражаются следующими несложными зависимостями:
![]()
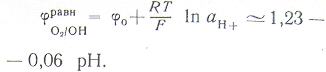
![]()
Нетрудно найти, что в нейтральной среде (рН 7) равновесный потенциал водородного электрода равен —0,414 в и кислородного электрода +0,815 в; при рН 0 эти потенциалы составляют 0,0 и +1,229 в и называются стандартными; при рН 14 равны —0,828 и +0,401 в соответственно. В атмосфере парциальное давление кислорода составляет 0,21 атм; при этом равновесный потенциал кислородного электрода снижается на 0,01 в.
Таким образом, во всем интервале рН равновесный потенциал кислородного электрода положительнее равновесного потенциала водородного электрода на 1,23 в. Может сложиться впечатление, что в любых условиях коррозия должна протекать исключительно или преимущественно с кислородной деполяризацией.
Действительно, термодинамически коррозия с водородной деполяризацией менее вероятна. Однако реализация термодинамической возможности определяется кинетическими факторами, которые влияют на поляризуемость электрода или, иначе, на перенапряжение электродных реакций. Как известно, перенапряжение, включая и концентрационную поляризацию, зависит от состава и концентрации электролита, от наличия в нем поверхностноактивных веществ, от температуры, давления, а также от скорости самого процесса. Все эти факторы и определяют окончательно тип коррозии в данных конкретных условиях.
Коррозия с водородной деполяризацией протекает обычно в растворах с высокой активностью водородных ионов или низкой активностью ионов корродирующего металла, а также при коррозии наиболее электроотрицательных металлов (щелочных, щелочноземельных, лантанидов, плутонидов).
Напомним, что для водородного электрода характерно перенапряжение, связанное с химической поляризацией и определяемое замедленной стадией разряда водородного иона. Поэтому те или иные причины, снижающие перенапряжение выделения водорода на металле, увеличивают скорость коррозии. Так, чистые металлы корродируют гораздо медленнее, чем металлы с примесями, смешивающими в катодную сторону потенциал выделения водорода. И наоборот, все, что повышает перенапряжение выделения водорода, тормозит скорость коррозии. Перемешивание коррозионной среды не оказывает существенного влияния на скорость процесса.
Коррозия с кислородной деполяризацией широко распространена в нейтральной среде или при небольшом сдвиге рН в ту или иную сторону от 7. Характерной особенностью является определяющая роль концентрационной катодной поляризации, которая лимитирует скорость коррозии в целом. Это объясняется двумя обстоятельствами: малой концентрацией кислорода, (из-за низкой его растворимости в электролитах) и незначительной скоростью диффузии кислорода.
Поэтому, в отличие от коррозии с водородной деполяризацией, здесь на скорость процесса заметное влияние оказывает перемешивание, повышение температуры и другие факторы, способствующие ускорению диффузии. С другой стороны, факторы, влияющие на химическую поляризацию, менее важны. Так, наличие примесей в металле, снижающих перенапряжение ионизации кислорода, не оказывает столь сильного влияния на скорость коррозии с кислородной деполяризацией. По этим же причинам при очень энергичном перемешивании или в случае очень тонких слоев электролита, контактирующего с воздухом, механизм диффузионной кинетики отступает на второй план. Решающую роль начинает играть перенапряжение ионизации кислорода со всеми вытекающими отсюда последствиями.
В промежуточных условиях (не слишком сильное перемешивание, некая средняя толщина слоя электролита) коррозия протекает по смешанному механизму.
Появление коррозии с кислородно-водородной деполяризацией зависит не только от соотношения равновесных потенциалов металла, кислородного и водородного электродов, но и от условий, определяющих наклон поляризационных кривых и величину диффузионного тока. Влияние взаимного расположения поляризационных кривых на скорость коррозионного процесса можно проследить по поляризационной диаграмме рис. 33.
Металл
![]() ,
судя по соотношению равновесных
потенциалов
,
судя по соотношению равновесных
потенциалов
![]() ,
,
![]() и
и
![]() ,
может корродировать только с
кислородной деполяризацией. Скорость
коррозии выражается током
,
может корродировать только с
кислородной деполяризацией. Скорость
коррозии выражается током
![]() (предельным током), величина которого
зависит от скорости диффузии
растворенного кислорода к поверхности
металла.
(предельным током), величина которого
зависит от скорости диффузии
растворенного кислорода к поверхности
металла.
Равновесный
потенциал металла
![]() и
по сравнению с
и
по сравнению с
![]() более электроотрицателен, тем не менее
скорость коррозии каждого из металлов,
как видно из рисунка, определяется все
тем же предельным током диффузии
кислорода. Именно в этом смысле природа
металла, как и степень его чистоты, не
имеет существенного значения при
коррозии с кислородной деполяризацией—конечно,
в известных пределах. Впрочем, металл
термодинамически способен корродировать
со смешанной деполяризацией, потому
что его равновесный потенциал отрицательнее
равновесного потенциала реакции
восстановления водорода.
более электроотрицателен, тем не менее
скорость коррозии каждого из металлов,
как видно из рисунка, определяется все
тем же предельным током диффузии
кислорода. Именно в этом смысле природа
металла, как и степень его чистоты, не
имеет существенного значения при
коррозии с кислородной деполяризацией—конечно,
в известных пределах. Впрочем, металл
термодинамически способен корродировать
со смешанной деполяризацией, потому
что его равновесный потенциал отрицательнее
равновесного потенциала реакции
восстановления водорода.
Наконец, потенциал
металла
![]() настолько сдвинут в отрицательную
сторону, что становится возможным
протекание совместного разряда водородных
ионов до водорода, как и мо-
настолько сдвинут в отрицательную
сторону, что становится возможным
протекание совместного разряда водородных
ионов до водорода, как и мо-
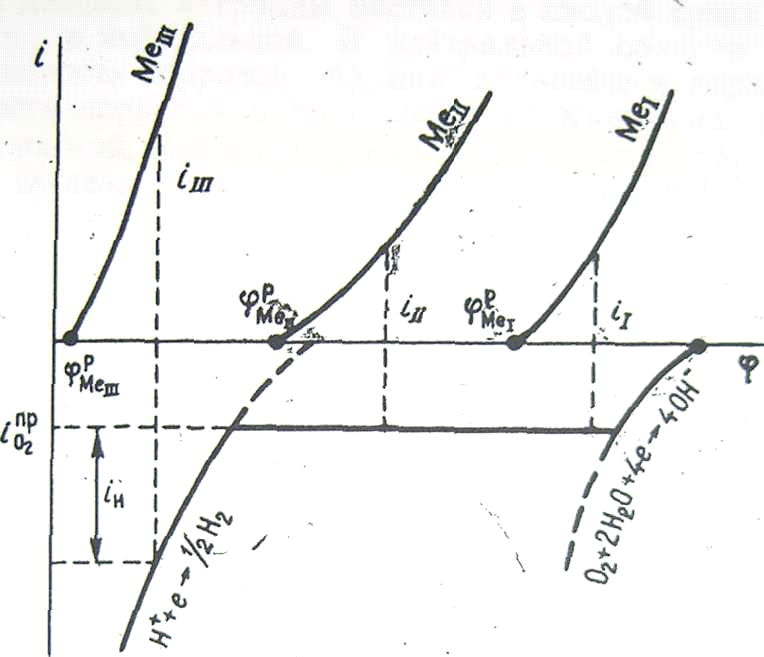
Рис. 33. Поляризационная диаграмма коррозии трех различных металлов с кислородной и кислородно-водородной деполяризацией.
лекул кислорода
до гидроксил-ионов. Каждая электродная
ре-
акция идет со своей скоростью:
первая — со скоростью
![]() ,
вто-
рая — со скоростью
,
вто-
рая — со скоростью
![]() .
Скорость коррозионного процесса
.
Скорость коррозионного процесса
![]() будет
равна
будет
равна
![]()
Как видно из рис. 33, в данном случае эти скорости соизмеримы по величине, но определяющей является реакция восстановления водорода. Именно изменение величины перенапряжения выделения водорода способно увеличить или уменьшить скорость коррозии.
Влияние внешних факторов на скорость коррозии
- Из внешних факторов, влияющих на скорость, вид и распространение коррозионного процесса, рассмотрим следующие: рН. коррозионной среды, состав и концентрацию нейтральных растворов, концентрацию растворенного кислорода, скорость движения металла относительно среды, температуру среды.
Влияние рН среды. В каждом конкретном случае вероятность коррозионного поведения того или иного металла в зависимости от рН среды можно проследить по соответствующей диаграмме равновесный потенциал — рН при комнатной температуре (диаграмма Пурбэ). Диаграммы обычно строятся для ряда значений активности ионов металла (1, 10-2 , 10-1 и 10-6 моль/л). Область потенциалов широка настолько, чтобы на диаграмму можно было нанести все* ионные равновесия, как. окислительно-восстановительные, так и гидратобразования,. отражающие образование всех возможных ионов или соединений с участием металла, в том числе при взаимодействии его с ионами Н+ и ОН".
Диаграмма Пурбэ позволяет однозначно определить область коррозионной устойчивости (иммунности), в которой металл термодинамически не способен окисляться; она позволяет также прогнозировать области пассивного и коррозионноактивного состояния металла. Вместе с тем диаграмма далеко не всегда-способна дать однозначный ответ о коррозионном поведении металла в силу того, что характеризует равновесное состояние системы, тогда как коррозионный процесс — всегда процесс неравновесный, подверженный влиянию многих кинетических факторов.
В общем случае коррозии с водородной деполяризацией повышение концентрации Н+ смещает катодный потенциал в положительную сторону, что должно увеличивать скорость коррозии. Но в сильнокислых растворах многое зависит от природы кислоты. Кислота может играть роль окислителя, вызывая пассивацию металла, как это происходит с железом в концентрированной H2SO4. В других случаях кислота взаимодействует с металлом с образованием труднорастворимой защитной пленки соли. По причине образования MgF2 магний стоек в плавиковой кислоте, из-за образования Fe3(P04)2 железо не корродирует в фосфорной кислоте.
Природа металла также достаточно четко проявляется во влиянии рН на скорость коррозии. По характеру этой зависимости при комнатной температуре металлы можно разбить на 5 групп (рис. 34).
Группа 1 — благородные металлы (Pt, Au, Ag и др.) и в известной мере титан, на коррозию которых рН не оказывает влияния (рис- 34, а).
Группа II — амфотерные металлы, достаточно устойчивые в нейтральной области, но нестойкие в кислой и щелочной средах. Это цинк, алюминий, олово, свинец (рис- 34, б).
Группа III — молибден, вольфрам, тантал, вполне устойчивые в кислой и нейтральной областях рН, но заметно корродирующие в щелочной (рис. 34, :в).
Группа IV — никель, кобальт, кадмий, скорость коррозии которых невелика и не зависит от рН в нейтральной и щелочной средах. В области малых значений рН подкисление увеличивает скорость коррозии (рис. 34, г).
Наконец, металлы V группы нестойки в кислой среде и умеренно стойки в нейтральной. В нейтральной области рН не влияет на скорость коррозии, но при дальнейшем подщелачивании скорость коррозии падает, достигая минимума при рН 12-14. Это магний, марганец, хром, медь, железо (рис. 34, д). Особенность железа проявляется в том, что при рН выше 14
а б в г д

pН рН рН рН рН
Рис. 34. Влияние рН среды "на скорость коррозии ряда металлов. а — благородные металлы; б —амфотерные металлы; в —молибден, вольфрам, тантал; г — никель, кобальт, кадмий; д— железо, марганец, хром.
стойкость резко падает из-за образования растворимого гипоферрита HFeO2-.
Влияние состава и концентрации нейтральных солей. Чаще всего в нейтральной среде протекает коррозия с кислородной деполяризацией. Влияние нейтральных солей на скорость коррозии проявляется через свойства образующихся продуктов коррозии. При образовании труднорастворимых соединений происходит частичное или полное экранирование поверхности металла, скорость коррозии падает. Например, углекислые соли калия или натрия образуют на поверхности цинка или железа осадок солей ZnCO3 или ∙FеСОз; свинец в растворе сернокислой соли покрывается плотным слоем PbS04. Соли могут образовывать на металле и окисные слои, пассивирующие поверхность. К пассиваторам относятся КСrO4, К2Сr2О7, КМnО4 и др.
Азотнокислые, хлористые и нередко сернокислые соли, наоборот, обычно образуют растворимые соединения, не способные замедлять процесс. Хлористые соли, кроме того, наряду с другими солями галогеноводородных кислот обладают способ-ностью активировать поверхность, что ускоряет скорость коррозии. Активирующий эффект возрастает в ряду J-—Вг-—С1-—F-.
Влияние' состава солей, склонных к гидролизу (например, AlCl3, CH3COONa) определяется тем, в какую сторону в результате гидролиза будет изменяться рН среды.
Концентрация
нейтральных солей также влияет на
скорость коррозии. Как видно из рис. 35,
повышение концентрации до-некоторых
значений увеличивает скорость процесса.
В общем случае это связано с возрастанием
электропроводности раствора; в данном
примере играет роль и усиление
активирующего эффекта хлор-иона.
Дальнейший рост концентрации приводит
к замедлению коррозии из-за заметного
снижения растворимости кислорода,
участвующего в катодной реакции.
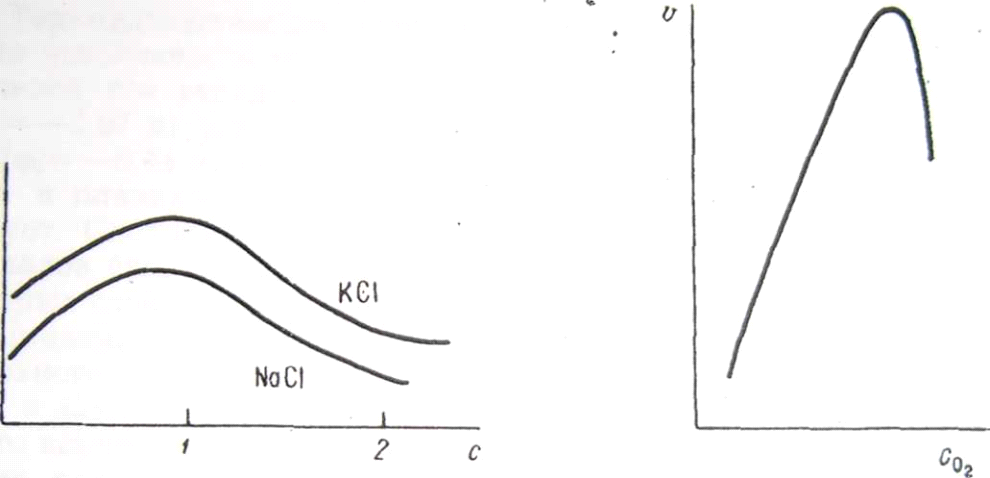
Рис. 35. Влияние концентрации нейт- Рис. 36. Влияние кон-
ральных солей на скорость коррозии центрации кислорода на
стали. скорость коррозии желе-
за в дистиллированной, воде.
Влияние кислорода. Скорость коррозии металлов в нейтральной среде существенно зависит от концентрации растворенного в коррозионной среде кислорода, который обеспечивает протекание катодного процесса. Источником кислорода в подавляющем большинстве случаев является воздух. Влияние кислорода на коррозию косвенно наблюдается на рис. 35. Более четко эта связь видна на рис. 36, на котором показана зависимость скорости коррозии стали в дистиллированной воде от содержания в ней кислорода. Скорость коррозии прямо пропорциональна концентрации кислорода, что отвечает механизму диффузионной кинетики электрохимического процесса. Прямая зависимость наблюдается до тех пор, пока слишком высокая концентрация кислорода не приводит к пассивации поверхности металла. Содержание кислорода в коррозионной среде
в свою очередь зависит как от состава и концентраций солей, так и от температуры, условий перемешивания и других факторов, определяющих растворимость кислорода.
Неравномерное поступление кислорода к поверхности металла (неравномерная или дифференциальная аэрация) способно. вызвать энергичную местную коррозию, скорость которой будет определяться степенью неравномерности. Эффект неравномерной аэрации демонстрирует знаменитый опыт Эванса. Два совершенно одинаковых стальных электрода, соединенных миллиамперметром, помещаются в сосуд с 3%-ным раствором хлористого натрия. Электроды отделены один от другого пористой диафрагмой. Если теперь у поверхности одного из электродов при помощи барботера воздуха повышать концентрацию кислорода, его потенциал начнет смещаться в положительную сторону, а в цепи электродов появится ток коррозии. Чем выше «скорость ; продувания воздуха, тем энергичнее корродирует тот электрод, который не подвергается аэрации. Такой коррозионный элемент называется аэрационным. Он моделирует процесс, часто встречающийся на практике в условиях атмосферной, подземной или морской коррозии.
Влияние температуры. Если коррозия протекает с водородной деполяризацией, то рост температуры должен увеличивать скорость коррозии. Причина этому — снижение перенапряжения выделения водорода, а наряду с этим — ускорение диффузии, уменьшение электросопротивления среды. При коррозии некоторых металлов, в частности стали, в азотной или соляной кислотах скорость коррозии связана с температурой уравнением Аррениуса.
Скорость коррозии с кислородной деполяризацией, как сильно зависящая от концентрации кислорода, с ростом температуры может замедляться. Повышение температуры настолько снижает растворимость кислорода в электролитах, что это обстоятельство оказывается решающим.
В отдельных случаях повышение температуры может привести к пассивации металла. Так, цинк в дистиллированной воде до 50°С достаточно хорошо защищен пленкой гидроокиси, при температуре около 60^С происходит депассивация поверхности, но в дальнейшем, в интервале 90—100°С, снова наступает устойчивая пассивация, и коррозия почти прекращается.
Влияние скорости движения коррозионной среды. * Влияние скорости движения коррозионной среды на скорость разрушения металла особенно четко проявляется при коррозии с кислородной деполяризацией. Движение раствора способствует повышению концентрации кислорода в приэлектродном слое.
а также удалению продуктов коррозии, способных пассивировать поверхность. Все это увеличивает скорость коррозии. При значительных скоростях возможна и пассивация поверхности за счет слишком высокой концентрации кислорода. Наконец» при еще большем повышении скорости движения среды появляются очаги коррозионной эрозии как результат комбинированного воздействия процессов электрохимического и механического разрушения металла.
