
- •Глава II коррозия металлов
- •§ 1. Определение и методы исследования коррозии.
- •1.1 Классификация
- •Методы оценки коррозии.
- •Методы коррозионных исследований
- •§2. Химическая коррозия Внешние факторы газовой коррозии.
- •Окисные пленки.
- •Коррозия в неэлектролитах.
- •§ 3. Электрохимическая коррозия Причины возникновения коррозии
- •Коррозия с водородной и кислородной деполяризацией
- •Влияние внутренних факторов на скорость коррозии
- •Атмосферная коррозия
- •Морская коррозия
- •Подземная коррозия
- •Электрокоррозия
- •§ 4. Методы защиты от электрохимической коррозии
- •Обработка коррозионной среды
- •Катодная защита
- •Протекторная защита
- •Анодная защита
- •§ 4. Диаграммы потенциал – рН (диаграммы Пурбэ)
Коррозия в неэлектролитах.
Коррозия металлов в неэлектролитах представляет собой разновидность химической коррозии. Органические жидкости, не обладающие электропроводностью, исключают возможность протекания электрохимических реакций. К ним относятся широко распространенные органические растворители, такие ,как бензол, толуол, четыреххлористый углерод и жидкие топлива (мазут, керосин, бензин). Диэлектриком являются и некоторые неорганические вещества: жидкий бром, расплавленная сера, жидкий фтористый водород. Коррозия в непроводящих средах независимо от их природы сводится к химической реакции между металлом и веществом.
Наиболее практически важной областью изучения является коррозия металлов в среде жидкого топлива - нефти и продуктов ее перегонки. Коррозионноактивными компонентами нефти являются сера и сернистые соединения - сероводород, сероуглерод, тиофены, меркаптаны и др. Нефть различных месторождений содержит эти соединения в пересчете ' на серу от 0,01 до 5-%. В продуктах перегонки нефти сера распределяется в еще более широком интервале. Чем тяжелее фракция перегонки в ряду бензин - керосин - мазут, тем выше содержание серы. Поэтому мазут представляет собой более агрессивную среду, чем исходная сырая нефть.
Различные сернистые соединения влияют на металлы неодинаково. Сероводород образует сульфиды с железом, свинцом и сплавами свинца, медью и сплавами меди. Меркаптаны действуют на медь и сплавы меди, свинец и сплавы свинца, никель, серебро. При этом образуются металлические производные меркаптанов - меркаптиды. Элементарная сера реагирует с медью, ртутью, серебром, образуя сульфиды.
Повышение температуры увеличивает скорость коррозии металлов в сернистой нефти, как, впрочем, и в других коррозионноактивных органических жидкостях - в фенолах, крекинг-бензине. Заметно активизирует процесс даже небольшое количество воды. Механизм влияния воды на скорость коррозии сводится к появлению электрохимической коррозии. Известны случаи, когда металл стоек в чистых органических соединениях вплоть до температуры их кипения, но начинает заметно корродировать даже при комнатной температуре при появлении малых количеств влаги (углеродистая сталь в четыреххлористом углероде).
Основная мера борьбы с коррозией в неэлектролитах - применение коррозионностойких материалов, прежде всего нержавеющей стали, а также алитированной стали. Что касается нефти и нефтепродуктов, то в большинстве случаев фактически приходится иметь дело не столько с химической, сколько с электрохимической коррозией. Поэтому наряду с применением коррозионностойких материалов в этой области техники широко используются всевозможные ингибиторы, а также протекторная защита. Эти и другие методы электрохимической защиты будут рассмотрены в § 4
§ 3. Электрохимическая коррозия Причины возникновения коррозии
Электрохимическая коррозия металла может проявиться во всех тех случаях, когда имеет место граница раздела фаз металл— электролит. Факт появления коррозии не зависит от природы электролита, будь это сверхчистая вода или расплавленная соль. Не имеет существенного значения и количество электролита— в предельном случае это может быть пленка влаги толщиной в несколько десятков миллимикрон. Единственным условием является возможность совмещения на металлической поверхности анодной реакции ионизации металла и катодной реакции восстановления тех или иных ионов или молекул. Такая возможность реализуется, если равновесный потенциал анодной реакции окажется отрицательнее равновесного потенциала хотя бы одной катодной реакции. Тогда установившийся компромиссный (стационарный) потенциал займет промежуточное положение.
Это условие обязано соблюдаться независимо от разновидности коррозии — от атмосферной до коррозии под действием блуждающих токов. В каждом из случаев мы будем иметь дело с частным проявлением неравновесных электродных процессов «и можем объяснить механизм протекания реакций с позиций закономерностей электрохимической кинетики. Поэтому саму теорию коррозии удобно называть кинетической или теорией Фрумкина—Вагнера — Шултина, по имени ученых, разработавших основные ее принципы. Первое знакомство с этой теорией происходит при изучении основ теоретической электрохимии.
Теория процесса.
Важно уяснить, что кинетическая теория
коррозии справедлива применительно
даже к идеально чистому металлу.
Действительно, при погружении чистого
металла в
водный
раствор его соли устанавливается
равновесие Me
↔Меn
+
+ nе,
отвечающее равновесному потенциалу![]() .
Это означает, что скорости ионизации
.
Это означает, что скорости ионизации
![]() и разряда
и разряда
![]() равны и составляют ток обмена
равны и составляют ток обмена
![]() .
Равновесное состояние свидетельствует
об ^отсутствии коррозии, что возможно
только в том
случае, если мыслимый в данных условиях
катодный процесс (например, восстановление
водородного иона) имеет равновесный
потенциал
.
Равновесное состояние свидетельствует
об ^отсутствии коррозии, что возможно
только в том
случае, если мыслимый в данных условиях
катодный процесс (например, восстановление
водородного иона) имеет равновесный
потенциал
![]() отрицательнее
потенциала ионизации металла.
отрицательнее
потенциала ионизации металла.
Если, наоборот, > , то на границе раздела фаз металл — раствор устанавливается равновесие
+![]() =
+
=
+![]() ,
,
соответствующее уже двум различным реакциям:
Me ↔Меn + + nе,
nH++ne↔n/2H2.
При этом, исходя из неравенства > , имеем
> и <
В результате будет происходить преимущественная ионизация, или разрушение, металла при стационарном потенциале φстац, который соответствует неравенству
<![]() <
.
<
.
Если ток обмена металла по абсолютной- величине превышает ток обмена водорода (поляризуемость катодного процесса больше из-за большего перенапряжения выделения водорода), то стационарный потенциал приблизится к равновесному потенциалу металла.
Этот вариант показан схематично на рис. 28, а и представлен поляризационными кривыми рис. 28, б. На схеме сумма векторов тока ионизации металла и водорода равна сумме век-
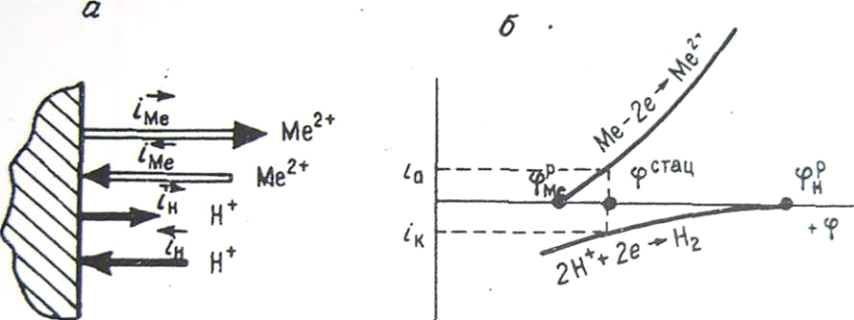
Рис. 28. Схема установления стационарного потенциала коррозии при токе обмена металла выше тока обмена водорода (а) и поляризационная диаграмма сопряженных электродных реакций (б).
торов тока их
восстановления. Следовательно,
стационарный потенциал установился. В
то же самое время абсолютная величина
скорости каждой из электродных реакций
с участием металла заметно превышает
скорости реакций с участием водорода.
Это связано со значительным различием
токов обмена
![]() и
и
![]() ,
которые не сильно отличаются от
соответствующих токов ионизации и
разряда. Судя по рис. 28, б, коррозия
металла протекает со скоростью ia,
а выделение водорода происходит с
равной ей скоростью iк.
,
которые не сильно отличаются от
соответствующих токов ионизации и
разряда. Судя по рис. 28, б, коррозия
металла протекает со скоростью ia,
а выделение водорода происходит с
равной ей скоростью iк.
Аналогичным образом можно показать, что при токе обмена водорода, превышающем ток обмена металла, стационарный потенциал приближается к равновесному потенциалу водорода. В этом случае перенапряжение реакции ионизации металла будет выше перенапряжения выделения водорода.
Анодный процесс при коррозии всегда заключается в ионизации металла. В катодном процессу могут участвовать разнообразные ионы или молекулы, являясь по отношению к металлу окислителями. Мыслимы следующие основные типы катодных реакций:
1. Восстановление катиона:
Н+ + е → 1/2Н2,
Ag+ + е → Ag.
2. Восстановление аниона:
S2О82- + 2е → 2SO42-,
![]()
3. Восстановление молекул растворенного в электролите газа:
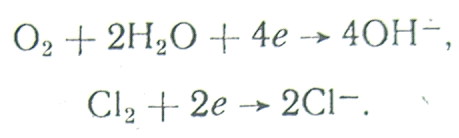
4. Восстановление окисных или гидроокисных пленок:
![]()
5. Восстановление органических молекул:
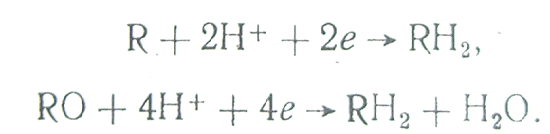
В электролите, как правило, присутствуют два или даже несколько окислителей. Так, в водном растворе наряду с водородными ионами всегда содержится некоторое количество растворенного кислорода и нередко органические примеси. Их совместное влияние на скорость анодного процесса будет зависеть от взаимного расположения катодных поляризационных кривых по отношению к анодной кривой. Рассмотрим случай с двумя окислителями.
На рис, 29 даны
поляризационные кривые
![]() ,
отвечающие
двум катодным реакциям, протекающим с
близким перенапряжением.
,
отвечающие
двум катодным реакциям, протекающим с
близким перенапряжением.
Согласно принципу
аддитивности поляризационных кривых
можно построить суммарную катодную
кривую![]() .
В присутствии только окислителя I
скорость коррозии была бы равна
.
В присутствии только окислителя I
скорость коррозии была бы равна
![]()
при стационарном
потенциале
![]() ,
в присутствии только окислителя II
— скорость
равна
,
в присутствии только окислителя II
— скорость
равна
![]() при
потенциале
при
потенциале
![]() .
Но если равновесный потенциал
.
Но если равновесный потенциал
![]() менее энергичного окислителя
положйтельнее стационарного потенциала
менее энергичного окислителя
положйтельнее стационарного потенциала
![]() более
более
энергичного (см.
рис. 29),
в коррозионном процессе принимают
участие
оба окислителя. Скорость коррозии при
этом оказывает-
ся выше, чем в более
энергичном окислителе. Действительно,
Из
рисунка
видно, что
![]() .
В то же время доля
.
В то же время доля
участия каждого из окислителей снижается, так как стационар-
ный потенциал сместился
вправо, в сторону мень-
шего Катодного
тока. Иными словами, при совместном
участии
в коррозионном процессе двух
катодных реакций скорость
каждой из
реакций становится ниже* чем при
раздельном учас-
тии:
![]() .
.
Технически чистые металлы всегда загрязнены примесями, а сплавы содержат еще и легирующие добавки; поверхность
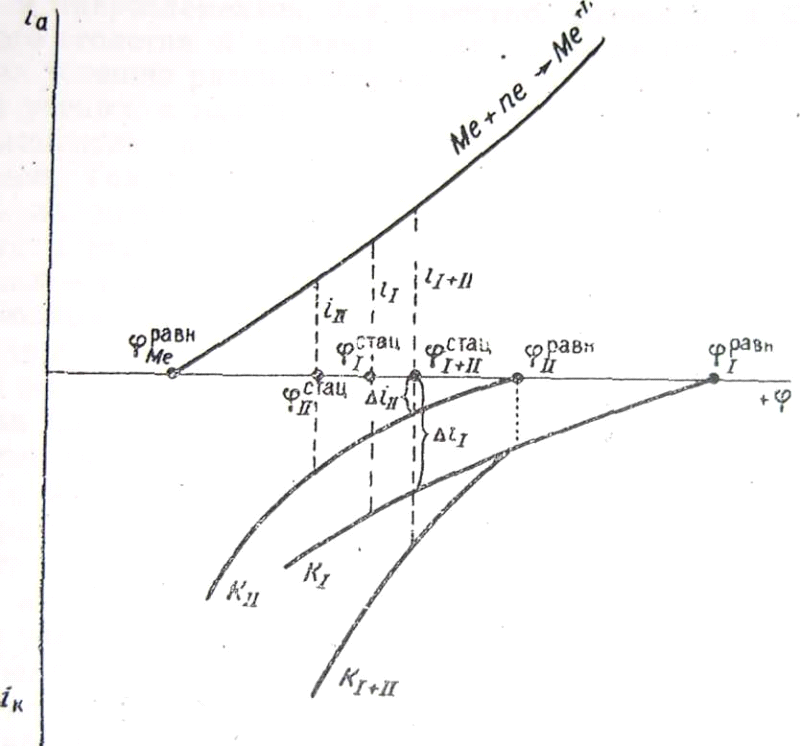
Рис. 29. Поляризационная диаграмма коррозии металла в присутствии двух окислителей (оба окислителя участвуют в коррозионном процессе).
технических металлов характеризуется структурной и термодинамической неоднородностью. Поэтому коррозия в реальных условиях — это коррозия многокомпонентного металла с неравновесным .состоянием поверхности.
Каждому из металлических включений, каждому из термодинамически неоднородных участков соответствуют свои равновесные потенциалы катодных и анодных реакций и своя поляризуемость. Результирующая скорость коррозии, как и сама возможность коррозии основного металла или металла-примеси, определяется соотношением всех поляризационных кривых.
В
качестве характерного примера рассмотрим
случай коррозии металла
![]() ,
имеющего включения металла
,
имеющего включения металла
![]() .
Поляризационные анодные кривые, как
видно из рис. 30, заметно отстоят одна от
другой; металл
значительно электроположительнее
металла
.
.
Поляризационные анодные кривые, как
видно из рис. 30, заметно отстоят одна от
другой; металл
значительно электроположительнее
металла
.
Для простоты допустим, что сопряженной катодной реакцией для каждого металла может быть только восстановление водорода.
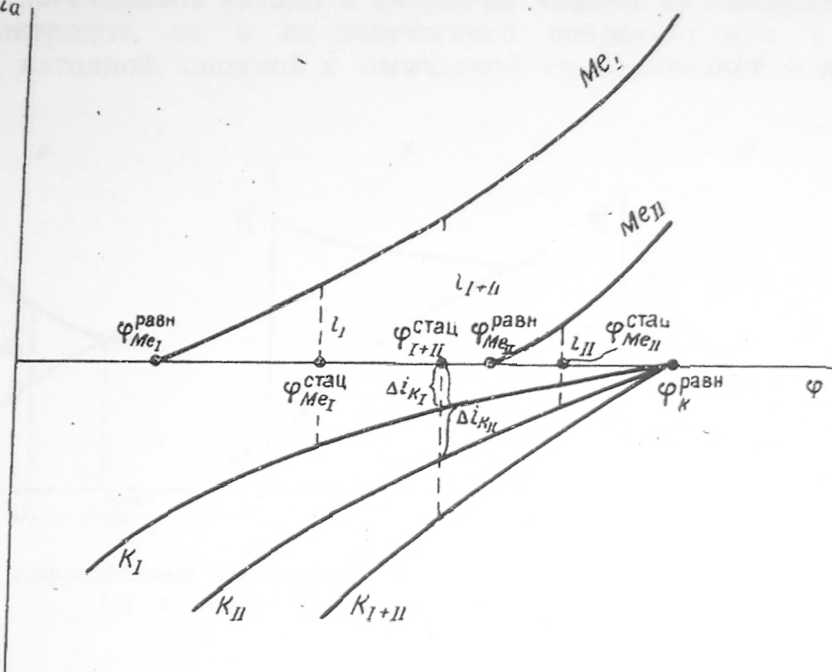
Рис. 30. Поляризационная диаграмма коррозии двух контактирующих металлов (металл I защищает металл II от коррозии).
В случае полной электрической изоляции каждый металл корродировал бы с определенной и взаимно независимой скоростью . Но металлы находятся в контакте. Поэтому катодная поляризационная кривая равна суммарной .При этом оказывается, что скорость коррозии возросла до , но корродирует только металл, потому что стационарный потенциал отрицательнее равновесного потенциала . Что касается водорода, то он выделяется как на металле , так и на металле , но с неодинаковой скоростью. Скорость катодной реакции гораздо ниже, чем скорость реакции.
В результате
коррозии по схеме рис. 30
в цепи
![]() протекает, несмотря на контакт металлов,
электрический ток. Если переходное
сопротивление в месте контакта ощутимо,
то . каждый металл будет обладать своим
стационарным потенциалом, отличающимся
от
протекает, несмотря на контакт металлов,
электрический ток. Если переходное
сопротивление в месте контакта ощутимо,
то . каждый металл будет обладать своим
стационарным потенциалом, отличающимся
от
![]() .
Скорость
коррозии при этом будет снижаться за
счет омических потерь на границе
.
Скорость
коррозии при этом будет снижаться за
счет омических потерь на границе
![]() .
Такой же эффект будет оказывать понижение
электропроводности электролита
(коррозионной среды).
.
Такой же эффект будет оказывать понижение
электропроводности электролита
(коррозионной среды).
Ток, протекающий в системе металл — электролит — металл, называется локальным, а сама система представляет собой своеобразный гальванический элемент, включенный накоротко. Теория, объясняющая механизм коррозии работой многочисленных макро- и микроэлементов, как известно, возникла в 30-е годы прошлого столетия и связана с именем де ля Рива. В дальнейшем она успешно развивалась благодаря усилиям многих крупнейших ученых, в том числе Акимова и Эванса. Теория локальных элементов подкупает убедительностью и доступностью понимания. Так, качественные закономерности коррозии удобно изучать на моделях гальванических элементов. Получаемые результаты весьма наглядны в виде коррозионных диаграмм потенциал — ток (диаграммы Эванса), хотя поляризационные коррозионные диаграммы Шултина потенциал — плотность тока более строги.
В то же время теория де ля Рива—Эванса—Акимова, как основанная на принципе пространственного разделения катодных и анодных участков, не вполне отвечает современным представлениям о механизме электродных реакций. Количественные расчеты в рамках этой теории крайне затруднены, так как далеко не просто определить суммарные поверхности всех катодных и всех анодных участков металла в отдельности. Нередко некоторые участки являются катодными в системе одной пары и анодными - в системе другой.
Согласно теории локальных элементов окислители, обеспечивающие протекание катодной реакции, называются деполяризаторами, а сам катодный процесс — деполяризацией. Эти термины являются общепринятыми, хотя сегодня они уже не соответствуют по физическому смыслу современным взглядам на электродные процессы, протекающие в гальванических элементах.
И все же теория локальных элементов как теория электрохимическая не должна противопоставляться кинетической теории. Скорее наоборот, эти теории эффективно дополняют одна Другую при сохранении ведущего положения за кинетической теорией.
Коррозионная диаграмма Эванса. Качественные закономерности процесса коррозии принято рассматривать на поляризационных коррозионных диаграммах Эванса, построенных в координатах потенциал — ток. В рассматриваемом на рис. 31, а случае ток коррозии должен быть равен .Если же сопротивление коррозионной среды и переходное сопротивление между катодными и анодными участками металла достаточно велики, то коррозионный ток снизится до.. Тогда величина будет представлять собой общее омическое падение напряжения в цепи коррозионного элемента. В первом случае поверхность металла эквипотенциальная, во втором нет.
Таким образом,
коррозионная диаграмма показывает, что
величина тока коррозии зависит не только
от значений равновесных потенциалов
катода и анода, не только от поляризуемости
электродов, но и от омического сопротивления
в цепи. Вклад катодной, анодной и омической
составляющей в коррозионный процесс
может быть далеко не одинаковым. Ту
составляющую, которая лимитирует
процесс, оказывая наибольшее . влияние
на величину тока коррозии, принято
называть контролирующей.
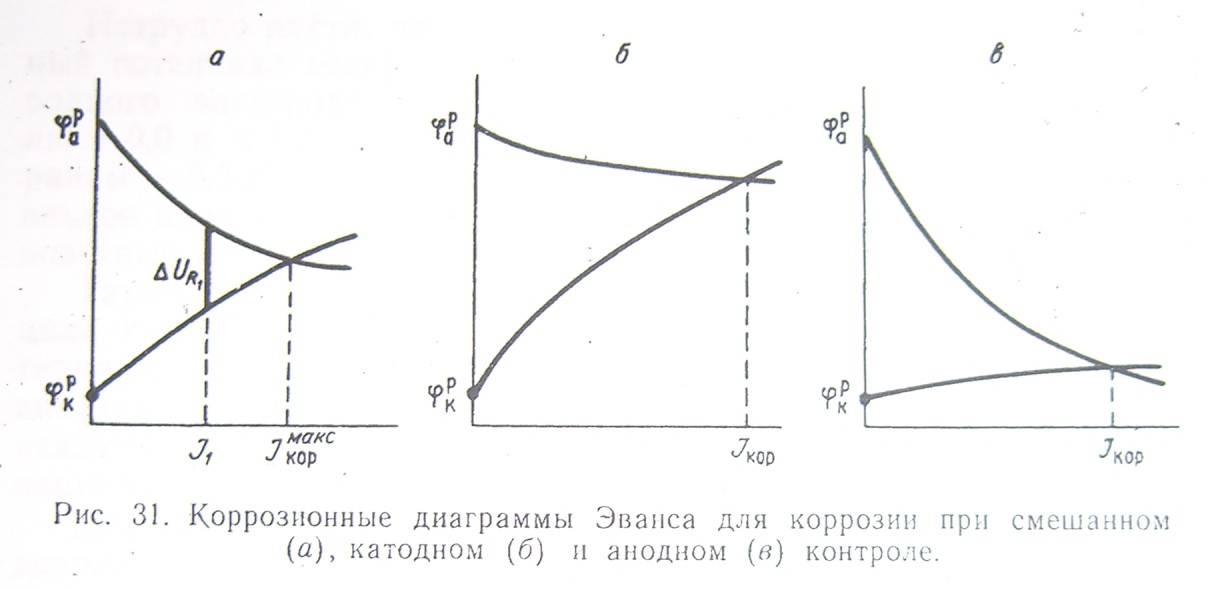
Значительная поляризуемость катодной реакции при малой поляризуемости анодной (рис. 31, б) указывает на катодный контроль коррозии. На рис. 31, в дана коррозионная диаграмма для случая анодного контроля. Если же решающую роль играет омическое сопротивление, то говорят об омическом контроле процесса.
Определить контролирующую составляющую коррозии не всегда удается визуально. Тогда прибегают к графическому анализу коррозионной диаграммы, показанному на рис. 32. На рисунке обозначены катодная поляризация , анодная поляризация и омическое падение напряжения . Степень контроля процесса может быть оценена из сравнения этих величин, отнесенных к разности равновесных потенциалов коррозионного элемента:
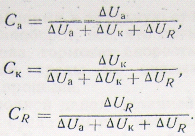
Если ни одно из значений не имеет явного преимущества, то контроль определяется как смешанный (смешанный катодно-анодный, смешанный катодно-омический) (рис. 31, а).

Равновесные потенциалы электродных реакций и сопротивление цепи, а также поляризуемость электрода зависят в свою очередь от природы, состава и свойств металла и электролита (коррозионной среды), а также от внешних условий, таких, как температура, перемешивание и др. Таким образом, на скорость коррозии металла будут влиять фактически самые разнообразные факторы, среди которых различают внешний и внутренние. К внешним факторам относят все, связанное с коррозионной средой, к внутренним — все, связанное с металлом.
Чтобы лучше понять влияние различных факторов на скорость коррозии, остановимся на особенностях двух основных типов катодной коррозионной реакции.
