
- •Глава II коррозия металлов
- •§ 1. Определение и методы исследования коррозии.
- •1.1 Классификация
- •Методы оценки коррозии.
- •Методы коррозионных исследований
- •§2. Химическая коррозия Внешние факторы газовой коррозии.
- •Окисные пленки.
- •Коррозия в неэлектролитах.
- •§ 3. Электрохимическая коррозия Причины возникновения коррозии
- •Коррозия с водородной и кислородной деполяризацией
- •Влияние внутренних факторов на скорость коррозии
- •Атмосферная коррозия
- •Морская коррозия
- •Подземная коррозия
- •Электрокоррозия
- •§ 4. Методы защиты от электрохимической коррозии
- •Обработка коррозионной среды
- •Катодная защита
- •Протекторная защита
- •Анодная защита
- •§ 4. Диаграммы потенциал – рН (диаграммы Пурбэ)
§ 4. Диаграммы потенциал – рН (диаграммы Пурбэ)
Диаграммы
потенциал
![]() -рН
удобны для графического
изображения равновесий в системах,
содержащих твердые
фазы и водные растворы. Они позволяют
в наглядной форме представить
термодинамически стабильные состояния
в зависимости от величины потенциала
рН. Ниже на примере некоторых систем
показано, как эти
диаграммы
строятся и используются.
-рН
удобны для графического
изображения равновесий в системах,
содержащих твердые
фазы и водные растворы. Они позволяют
в наглядной форме представить
термодинамически стабильные состояния
в зависимости от величины потенциала
рН. Ниже на примере некоторых систем
показано, как эти
диаграммы
строятся и используются.
Диаграмма -рН для воды
Вода может разлагаться сильными восстановителями с выделением водорода или сильными окислителями с выделением кислорода.
Построим диаграмму устойчивости воды. Равновесие восстановления воды можно выразить полуреакцией
H2(газ)
![]() + 2e
+ 2e
Для этой реакции при температуре 298 К
![]()
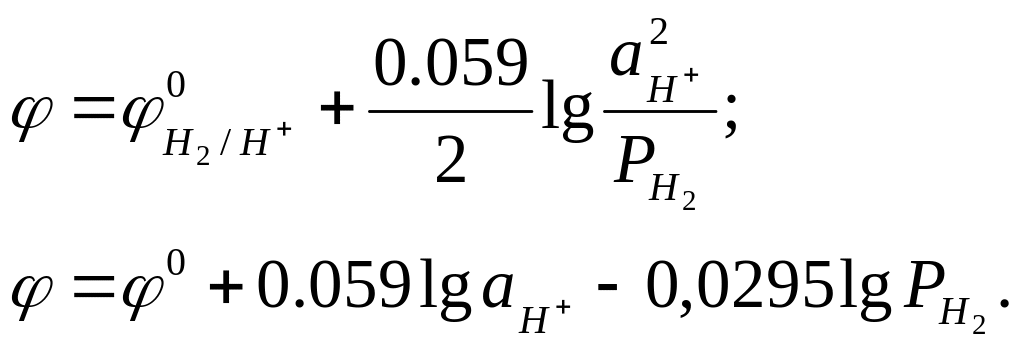
Поскольку
![]() =
0, то при
=
0, то при
![]() =
1 атм
=
1 атм
![]() = -0,059 рН (III.12)
= -0,059 рН (III.12)
Таким образом для реакции (III, II) зависимость -рН можно графически представить на диаграмме прямой линией cd с тангенсом угла наклона 0,059 (рис. 19). При изменении рН от 0 до 14 потенциал изменяется от 0 до -0,826 В. Для реакции окисления воды
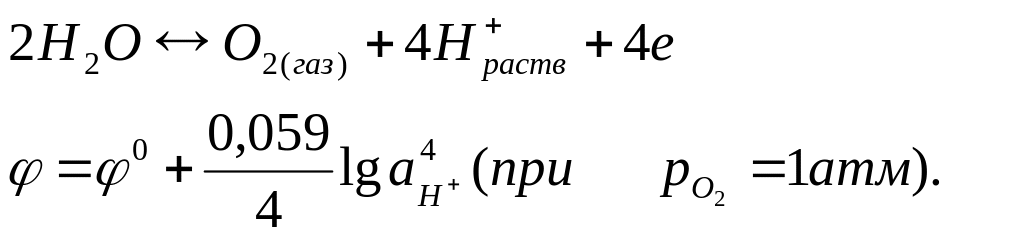 (III.13)
(III.13)
Поскольку стандартная величина э. д. с. элемента, состоящего из стандартного водородного электрода, в котором происходит реакция восстановления, и электрода, в котором протекает реакция окисления (III.13), равна
![]()
а
![]() =0,
то очевидно,
=0,
то очевидно,
![]() 0
,и,
в соответствии с уравнением (III.10):
0
,и,
в соответствии с уравнением (III.10):
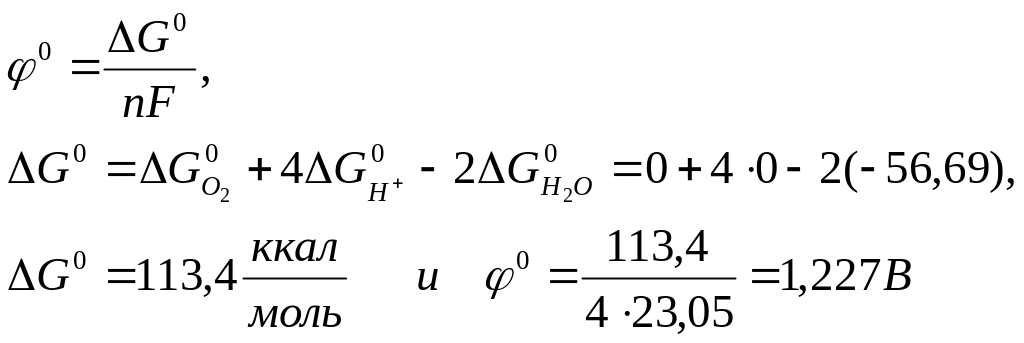
Отсюда
![]()
Или
![]() (III.14)
(III.14)
Эта зависимость представлена на диаграмме прямой ab. В пределах рН от 0 до 14 потенциал изменяется от 1,227 до 0,401 В.
Таким образом область устойчивости воды ограничена линиями ab и cd. Все восстановители с потенциалом ниже линии H2 - Н+ (cd) и окислители с потенциалом выше линии H2О—02 (ab) будут разлагать воду.
Например,
цинк в
широком
интервале рН разлагает
воду
(°![]() ).Ионы
Au3+
вытесняют кислород
из воды, так как для реакции
).Ионы
Au3+
вытесняют кислород
из воды, так как для реакции
![]()
стандартный потенциал равен +1,5 В.

![]()
Следует однако, учитывать, что ширина реальной области устойчивости воды больше, чем области, ограниченной линиями ab и cd, вследствие явления перенапряжения водорода и кислорода. Реальные пределы показаны на диаграмме пунктирными линиями a'b' и c'd'.
На диаграмме -рН для воды равновесные линии ab и cd отвечают давлению водорода 1 ат. Можно нанести на диаграмму линии зависимости -рН соответствующие другим давлениям водорода.
