
- •1. Механика
- •1.1. Кинематика
- •1.2. Динамика материальной точки и твердого тела
- •1.3. Законы сохранения
- •1.4. Элементы специальной теории относительности.
- •1.5. Элементы механики сплошных сред
- •1.6. Колебания и волны
- •2. Молекулярная физика и термодинамика
- •2.1. Статистическая физика и термодинамика
- •2.2. Статистические распределения
- •2.3. Основы термодинамики
- •2.4. Явления переноса
- •2.5. Реальные газы
- •3.Электричество и магнетизм
- •3.1. Электростатика
- •3.2. Постоянный электрический ток
- •3.3. Магнитное поле
- •3.4. Магнитное поле в веществе
- •3.5. Явление электромагнитной индукции
- •3.6. Уравнения Максвелла
- •3.7. Электромагнитные колебания
2. Молекулярная физика и термодинамика
2.1. Статистическая физика и термодинамика
Основные положения МКТ
Все тела состоят из атомов и молекул; молекулы непрерывно движутся и взаимодействию между собой
Средняя кинетическая энергия молекул идеального газа.
E=3/2kT
Молекулярно-кинетический смысл температуры.
Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы и определяющая направление теплообмена между телами.
Основное уравнение МКТ
P=1/3nm0Vкв2=2/3nEk
Модель идеального газа.
Молекулы – материальные точки, не взаимодействуют между собой, столкновение - упругое
Закон Авогадро.
Закон Авогадро: при одинаковом р и T 1 моль любого газа занимает одинаковый объем
Закон Дальтона.
Закон Дальтона: давление смеси газов равно сумме парциальных давлений, производимых каждым газом в отдельности.
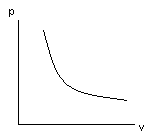
Уравнение и график изотермического процесса.
P1V1=
P2V2
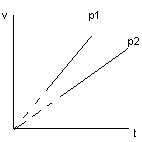
Уравнение и график изобарного процесса.
V1T2=
V2T1
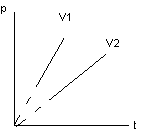
Уравнение и график изохорного процесса.
P1T2=
P2T1
Уравнение Менделеева-Клапейрона.
![]()
2.2. Статистические распределения
Распределение Максвелла.
Закон Максвелла о распределении молекул идеального газа по скоростям: в газе, находящемся в состоянии равновесия при данной температуре, устанавливается некоторое стационарное, не меняющее со временем распределение молекул по скоростям.
Наиболее вероятная скорость молекул идеального газа.
![]()
Средняя арифметическая скорость молекул идеального газа.
![]()
Среднеквадратичная скорость молекул идеального газа.
![]()
Барометрическая формула
![]()
Распределение Больцмана для частиц во внешнем потенциальном поле.
![]()
Из этого следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул.
2.3. Основы термодинамики
Внутренняя энергия идеального газа.
Это энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т.д.) и энергия взаимодействия этих частиц.
![]()
Число степеней свободы. Распределение энергии по степеням свободы.
Число степеней свободы – это число независимых переменных, полностью определяющих положение системы в пространстве. Одноатомный газ: 3 всего (3 поступательных), двухатомный: 5 всего (3 поступательных, 2 вращательных), многоатомные: 6 всего (3 поступательных, 3 вращательных)
Работа газа при изменении его объема.
![]()
Количество теплоты. Удельная и молярная теплоемкости.
Количество теплоты – это энергия, которая необходима для нагревания тела. Удельная теплоемкость – величина, равна количеству теплоты, необходимому для нагревания 1кг вещества на 1К. Молярная теплоемкость – величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1К.
Зависимость теплоемкости идеального газа от вида процесса. Уравнение Майера.
![]()
![]()
![]() -уравнение
Майера
-уравнение
Майера
Первое начало термодинамики.
Первое начало термодинамики является законом сохранения энергии для тепловых процессов
![]() ,
A,Q- функции
процесса, U-функция
состояния
,
A,Q- функции
процесса, U-функция
состояния
Какой процесс называется адиабатным? Уравнение Пуассона.
Адиабатный процесс – это процесс, при котором не происходит обмен теплом с окружающей средой.
![]() -уравнение
Пуассона
-уравнение
Пуассона
Применение первого закона термодинамики к изобарному процессу
![]()
Применение первого закона термодинамики к изохорному процессу.
![]()
Применение первого закона термодинамики к изотермическому процессу.
![]()
Работа газа при адиабатном процессе.
![]()
Какой процесс называется политропным? Уравнение политропы.
Процесс,
в котором теплоемкость остается
постоянной (C=const)
называется политропическим. Уравнение
политропы -
![]() ,
где коэффициент
,
где коэффициент
![]() называется показателем политропы.
называется показателем политропы.
КПД тепловой машины
![]()
Цикл Карно и его КПД.
Цикл
Карно состоит из двух изотерм и двух
адиабат.
![]()
Второе начало термодинамики
Невозможен процесс самопроизвольной передачи тепла от холодного тела к горячему.
Энтропия (определение, статистический смысл).
Энтропией
S называется функция
состояния системы, дифференциалом
которой является
![]() .
Энтропия является мерой неупорядочности
системы, большая энтропия соответствует
большему хаосу. Энтропия изолированных
систем не может убывать при любых
процессах.
.
Энтропия является мерой неупорядочности
системы, большая энтропия соответствует
большему хаосу. Энтропия изолированных
систем не может убывать при любых
процессах.
![]() =0
– для обратимых процессов,
>0
– для необратимых.
=0
– для обратимых процессов,
>0
– для необратимых.
Статистическое толкование второго начала термодинамики.
Второе начало термодинамики определяет направление протекания термодинамических процессов, указывая какие процессы в природе возможны, а какие нет.
