
- •Закон збереження маси.. Межі його застосування, значення для хімії
- •Закон сталості складу та його пояснення з погляду атомно-молекулярного вчення. Відхилення від закону збереження маси. Поняття про бертоліди та дальтоніди
- •Закон Авогадро та його наслідки. Молярний об*єм, відносна густина газу
- •Молекулярна маса та методи її визначення. Кількість речовини, молярна маса
- •Закон еквівалентів. Еквівалент елементу. Еквівалентна маса елемента та складних сполук
- •Властивості основних класів неорганічних сполук. Оксиди: основні, кислотні, амфотерні. Кислоти, основи, солі.
- •Свідчення про складну будову атома. Електрон, його властивості. Планетарна модель атома Резерфорда
- •Атомні спектри. Модель атома по Бору. Пояснення атомних спектрів водню та гідрогеноподібних атомів з позицій моделі Бора
- •Корпускулярно-хвильовий дуалізм матерії. Рівняння Де-Бройля. Хвильові властивості електрона.
- •Рівняння Шрьодінгера. Хвильова функція та її фізична інтерференція
- •Квантові числа, що характеризують електрон в атомі. Їх значення, межі зміни.
- •Енергетичні рівні, підрівні електрона в атомі. Поняття про електронні орбіта лі.
- •Порядок заповнення електронних енергетичних рівнів та підрівнів. Принцип Паулі. Правило Гунда.
- •Електронні формули та схеми. Приклади електронних формул для елементів різних періодів періодичної системи
- •Періодичний закон у формулюванні Менделеєва. Періодична система елементів: періоди, групи, головні та побічні підгрупи
- •Закон Мозлі. Сучасне формулювання періодичного закону.
- •Закономірності заповнення електронних оболонок в періодах. Валентні електрони.
- •Енергія іонізації, спорідненість до електрона, електронегативніть. Шкала електронегативностей елементів.
- •Утворення хімічного зв*язку та його основні види. Довжина та енергія зв*язку.
- •Ковалентний зв*язок. Механізм утворення, його характеристики
Закон збереження маси.. Межі його застосування, значення для хімії
Сума мас речовин, які вступили в реакцію, дорівнює сумі мас продуктів реакції. Складаючи рівняння реакцій, необхідно добирати стехіометричні коефіцієнти так, щоб число атомів відповідних елементів у вихідних речовин і продуктах реакції було однаковим. Закон збереження маси є окремим випадком більш загального закону збереження матерії. Маса речовин зберігається сталою в процесах, які супроводжуються порівняно невеликими енергетичними змінами, і саме такі порівняно невеликі енергетичні ефекти спост. при перебігу більшості хімічних реакцій.
Закон сталості складу та його пояснення з погляду атомно-молекулярного вчення. Відхилення від закону збереження маси. Поняття про бертоліди та дальтоніди
Закон був сформований Прустом: будь-яка чиста речовина, незалежно від способу її добування, має сталий якісний і кількісний склад. Виходячи з атомно-молекулярного вчення цей закон можна пояснити тим, що до складу даної конкретної сполуки входять тільки атоми певних хімічних елементів (якісний склад) і сполучаються вони в цілком певних співвідношеннях, які залежать від їхньої валентності (кількісний склад). Валентність – це здатність атомів одного хімічного елемента приєднувати певну кількість атомів іншого хімічного елемента. Коли утворюються складні речовини з двох елементів, атоми сполучаються так, що добуток числа атомів одного елемента на його валентність дорівнює добутку числа атомів на валентність другого елемента. Це правило викор. при складанні хімічних формул. Закон сталості складу може бути застосований до більшості хімічних сполук, у тому числі до молекулярних сполук з відносно низькою молекулярною масою, а також до йонних сполук. Наз. їх дальтонідами . Але чимало сполук у певних межах можуть плавно змінювати свій склад – бертоліди.
Закон Авогадро та його наслідки. Молярний об*єм, відносна густина газу
Вивчаючи реакції між газами, Гей-Люссак встановив, що виміряні за однакових умов (тиску й температури) об*єми газів, які вступають в реакцію, відносяться один до одного і до об*ємів газуватих продуктів, як невеликі цілі числа (закон об/*ємних співвідношень). Закон Авогадро: в рівних об*ємах різних газів за однакових умов (температури і тиску) міститься однакова кількість молекул. Він застосовується тільки для газів, оскільки в газах відстані між молекулами значно більші від власних розмірів молекул. Ці відстані залежать тільки від умов і не пов*язані з природою молекул. Тому й кількості молекул різних газів в однакових об*ємах рівні. Наслідки:
Рівне число молекул різних газів за однакових умов займають однакові об*єми.
Молі різних газів за однакових умов займають однакові об*єми (оскільки моль будь-якої речовини містить число Авогадро 6,0022*1023 молекул). Зокрема, за нормальних умов – (101325 Па і 273 К) молі різних газів займають об*єм 22,4 л. Це – молярний об*єм газу Vм0. Можна розрахувати молярну масу газу через його відносну густину за іншим газом з відомою молярною масою. Відносна густина D – це відношення густин двох газів за однакових умов.
D=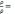 m1/V1/m2/V2.
Якщо
об*єми газів рівні між собою (V1=V2),
то D=m1/m2
m1/V1/m2/V2.
Якщо
об*єми газів рівні між собою (V1=V2),
то D=m1/m2
