
Гидролиз соединений с ковалентной связью.
Наиболее типичными ковалентными соединениями являются соединения двух, трех и более элементов, мало отличающихся по электроотрицательности.
Особенностью таких соединений является то, что они в большинстве случаев на ионы не распадаются, а при нагревании в присутствии воды подвергаются полному гидролитическому разложению:
B2S2 + 6HOH 2H3BO3 + 3H2S
P2S5 + 8HOH 2H3PO4 + 5H2S
PCl5 + 4HOH H3PO4 + 5HCl
SO2Cl2 + 2HOH H2SO4 + 2HCl
SiCl4 + 2HOH SiO2 + 4HCl
Нитриды металлов гидролизуются с образованием аммиака:
Na3N + 3H2O 3NaOH + NH3
AlN + 3H2O Al(OH)3 + NH3
Карбиды гидролизуются с образованием гидроксида или оксида соответствующего элемента и углеводородов:
Al4C3
+ 12H2O
![]() 4Al(OH)3
+ 3CH4
4Al(OH)3
+ 3CH4
SiC + 2H2O SiO2 + CH4
Гидролиз гидридов сопровождается окислительно-восстановительной реакцией: SiH4 + 2H2O SiO2 + 4H2
Количественные характеристики гидролиза.
Равновесное состояние гидролиза характеризуется постоянной величиной (при определенной температуре), называемой константой гидролиза Kг.
Поскольку при гидролизе имеет место конкуренция между двумя противоположными процессами, Kг зависит от константы диссоциации Kдисс. слабого электролита (Kосн или Kк-ты) и ионного произведения воды Kв.
Для случая гидролиза по катиону (NH4+):
NH4+ + HOH ⇄ NH4OH + H+

Так как [H2O] = const, то Kp∙[H2O] = const и обозначается Kг –это константа гидролиза.
Тогда 
Умножив числитель и знаменатель на [OH–], получим
 ,
т.к. [H+]∙[OH-]=Kв,
а
,
т.к. [H+]∙[OH-]=Kв,
а
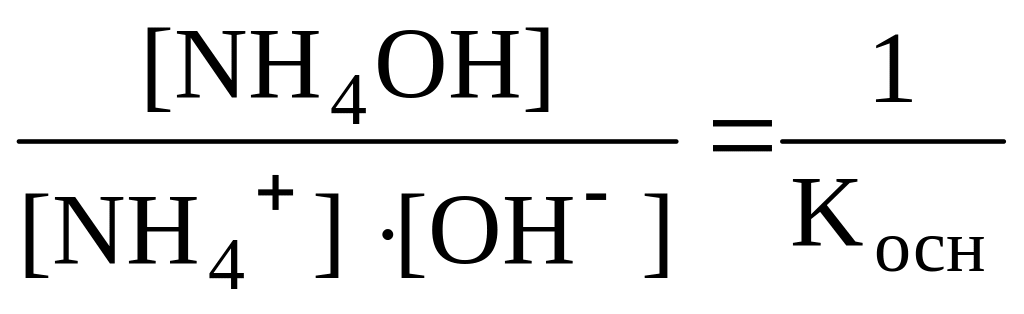 .
.
Аналогично
для гидролиза по аниону ![]() .
.
Для
гидролиза по катиону и аниону
одновременно: ![]() .
.
Для ступенчатой формы гидролиза константа имеет определенные значения для каждой ступени. В формуле учитывается константа диссоциации слабого компонента для соответствующей ступени диссоциации.
Для расчета Кг соли, разлагающейся с выделением осадка, константа диссоциации соответствующего вещества Кд должна быть заменена его произведением растворимости ПР.
Пользуясь выражениями констант гидролиза, можно выразить формулы для расчета рН в растворах гидролизованных солей. Для солей, образованных слабым основанием можно записать:
![]() .
.
Если соль сильный электролит, то [ион соли] = Cсоли.
Тогда ![]() .
.
Тогда ![]() .
.
Принимая Kв = 10-14 и учитывая pH = -lg[H+]; pKд = -lgKд.
Для солей, гидролизующихся по катиону имеем:
![]()
Для солей, образованных слабой кислотой и гидролизующихся по аниону, проводя аналогичные преобразования получим:
![]() .
.
При гидролизе солей третьего типа (по катиону и аниону) pH зависит только от величин констант диссоциации образующихся слабого основания и слабой кислоты.
Так как
![]() ,
то
,
то
![]() .
.
Интенсивность протекания гидролиза характеризуется степенью гидролиза hгидр - отношением числа гидролизованных молекул к общему числу растворённых молекул (выражается в процентах):
![]()
Факторы, влияющие на степень гидролиза.
Для солей, образованных обоими слабыми компонентами, степень гидролиза не зависит от концентрации раствора, а определяется только силой соответствующих основания и кислоты.
![]() .
.
Поэтому разбавление раствора, в этом случае, не влияет на степень гидролиза.
Степень гидролиза солей, образованных слабым основанием или слабой кислотой зависит от концентрации соли C (аналогично закону разбавления Оствальда):
![]()
![]()
![]() .
.
При разбавлении раствора степень гидролиза возрастает.
В этих случаях при разбавлении растворов возможно протекание гидролиза по второй и остальным ступеням. Например, для хлорида железа (III) при умеренном разбавлении происходит процесс:
![]()
При сильном разбавлении:
![]()
Степень гидролиза можно увеличить или уменьшить добавлением кислоты или щелочи, а также солей, имеющих в растворах кислую или щелочную реакцию среды.
Реакции нейтрализации являются экзотермическими процессами H++ OH- = H2O DH= -56 кДж, следовательно, гидролиз солей эндотермичен. На основании принципа Ле Шателье легко объяснить усиление гидролиза при повышении температуры. В горячих растворах гидролиз может настолько усилиться, что произойдет полное разложение соли. Например, при кипячении раствора хлорида железа FeCl3 можно довести гидролиз до конца, до выпадения осадка Fe(OH)3.
