
Структурная изомерия
Структурная изомерия — результат различий в химическом строении. К этому типу относят:Изомерия углеводородной цепи (углеродного скелета)
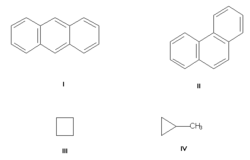
Изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода. Простейший пример — бутан СН3—СН2—СН2—СН3 и изобутан (СН3)3СН. Другие примеры: антрацен и фенантрен (формулы I и II, соответственно), циклобутан и метилциклопропан (III и IV).
Изомерия функциональной группы:Различается характером функциональной группы; например, этанол (CH3—CH2—OH) и диметиловый эфир (CH3—O—CH3).
Межклассовая - это изомерия между классами углеводородов. Например общей формуле CnH2n отвечают циклопарафины и этиленовые. они изомерны друг другу. Формуле CnH2n-2 отвечают как ацетиленовые так и диеновые. они тоже изомеры.
Изомерия положения
Тип структурной изомерии, характеризующийся различием положения одинаковых функциональных групп или кратных связей при одинаковом углеродном скелете. Пример: 2-хлорбутановая кислота и 4-хлорбутановая кислота.
Пространственная изомерия (стереоизомерия)
Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение.
Энантиомерия (оптическая изомерия)
Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами и физических свойств в хиральной среде).
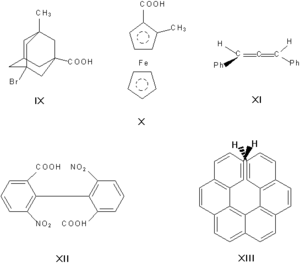
Асимметрическими могут быть и другие атомы, например атомы кремния, азота, фосфора, серы. Наличие асимметрического атома — не единственная причина энантиомерии. Так, имеют оптические антиподы производные адамантана (IX), ферроцена (X), 1,3-дифенилаллена (XI), 6,6'-динитро-2,2'-дифеновой кислоты (XII). Причина оптической активности последнего соединения — атропоизомерия, то есть пространственная изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков, нуклеиновых кислот, в гексагелицене (XII
геометрическая изомерия
отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).

Билет 15
1) Второй закон термодинамики
Вполне очевидно, что реакции с суммарным уменьшением энтальпии
(экзотермические) могут идти самопроизвольно, как катящийся с горы камень. Однако
хорошо известно, что самопроизвольно идут также некоторые реакции,
сопровождающиеся увеличением энтальпии и охлаждением реактора
(эндотермические).
Для характеристики эндотермических процессов и определения условий их
самопроизвольного осуществления была введена новая функция состояния –
энтропи’я .
Изменение энтропии равно (по определению) минимальной теплоте, подводимой к
системе в обратимом (все промежуточные состояния равновесны) изотермическом
процессе, деленной на абсолютную температуру процесса:
ΔS = Qмин./T
Появление такой функции состояния связано с необходимостью описать теплоту
методом обобщенных сил, аналогично любой работе (А), через обобщенную силу (F) и
обобщенную координату (в данном случае тепловую) [10]:
dA = Fdx
Для тепловых обратимых процессов получим:
dQ = TdS
Т.е. энтропия – это тепловая координата состояния, которая введена для
стандартизации математического аппарата термодинамики.
На данном этапе изучения термодинамики следует принять как постулат [11], что
существует некоторое экстенсивное свойство системы S, называемое энтропи’ей,
изменение которого так связано с процессами в системе:
В самопроизвольном процессе ΔS > Qмин./T
В равновесном процессе ΔS = Qмин./T
В несамопроизвольном процессе ΔS < Qмин./T
Для изолированной системы, где dQ = 0, получим:
В самопроизвольном процессе ΔS > 0
В равновесном процессе ΔS = 0
В несамопроизвольном процессе ΔS < 0
В общем случае энтропия изолированной системы или увеличивается, или остается
постоянной:
ΔS ≥ 0
Понятие энтропии возникло из полученных ранее формулировок второго закона
(начала) термодинамики. Энтропия – свойство системы в целом, а не отдельной
частицы.
Второе начало по У.Томсону (1851): “в природе невозможен процесс,
единственным результатом которого была бы механическая работа, совершенная за
счет охлаждения теплового резервуара”.
По Р.Клаузиусу (1850): “теплота сама по себе не может перейти от более
холодного тела к более теплому” или: “невозможно сконструировать машину, которая,
действуя посредством кругового процесса, будет только переносить теплоту с более
холодного тела на более теплое”.
Самая ранняя формулировка второго начала термодинамики появилась раньше
первого начала, на основании работы фр. С.Карно (1824) и ее математической
интерпретации фр. Э.Клапейроном (1834) как КПД идеальной тепловой машины:
КПД = (T1 - T2)/T1
Карно и Клапейрон сформулировали закон сохранения теплорода – невесомой
неуничтожимой жидкости, содержание которой определяет температуру тела. Теория
теплорода господствовала в термодинамике до середины XIX века
2) Адсорбция из водных растворов электролитов происходит, как правило, таким образом, что на твердом адсорбента из раствора адсорбируются преимущественно ионы одного вида. Преимущественная адсорбция из раствора или аниона, или катиона определяется природой адсорбента и ионов. Механизм адсорбции ионов из растворов электролитов может быть различным; выделяют обменную и специфическую адсорбцию ионов. ^ Обменная адсорбция представляет собой процесс обмена ионов между раствором и твердой фазой, при котором твердая фаза поглощает из раствора ионы какого-либо знака (катионы либо анионы) и вместо них выделяет в раствор эквивалентное число других ионов того же знака. Обменная адсорбция всегда специфична, т.е. для данного адсорбента к обмену способны только определенные ионы; обменная адсорбция обычно необратима. При специфической адсорбции адсорбция на поверхности твердой фазы ионов какого-либо вида не сопровождается выделением в раствор эквивалентного числа других ионов того же знака; твердая фаза при этом приобретает электрический заряд. Это приводит к тому, что вблизи поверхности под действием сил электростатического притяжения группируется эквивалентное число ионов с противоположным зарядом, т.е. образуется двойной электрический слой. Взаимодействие концентрирующихся на поверхности зарядов приводит к понижению поверхностной энергии системы. Для случая специфической адсорбции электролита Песковым и Фаянсом было сформулировано следующее эмпирическое правило (правило Пескова – Фаянса): На поверхности кристаллического твердого тела из раствора электролита специфически адсорбируется ион, который способен достраивать его кристаллическую решетку или может образовывать с одним из ионов, входящим в состав кристалла, малорастворимое соединение
ЛИОТРOПНЫЕ РЯДЫ - ряды ионов, расположенные в порядке усиления или ослабления их влияния на св-ва р-рителя (вязкость, поверхностное натяжение, растворяющую способность и др.), а также на скорость и глубину хим. р-ций и физ.-хим. процессов в данном р-рителе. Это влияние наз. лиотропным действием ионов и обусловлено гл. обр. сольватацией (в случае водных систем - гидратацией). Напр., по возрастающей способности адсорбироваться из водных р-ров на адсорбентах, уменьшению высаливающего и ослаблению коагулирующего действия и нек-рым др. св-вам составляются след. лиотропные ряды:
Li+< Na+ < NH4+< K+< Rb+ <Cs+< Tl+< Ag+,
Be2+<Mg2+ < Cd2+ < Ca2+< Sr2+< Ba2+,
F-< CH3COO-< НСОО-<Сl-< Вr-<NO3-< I-< CNS-.
Последовательность ионов в этих рядах соответствует уменьшению энергии гидратации. В том же порядке возрастает сродство катионов к сильнокислотным катионитам и анионов к сильноосновным анионитам в процессах ионного обмена. При изменении состава р-рителя, концентрации водородных ионов, т-ры порядок расположения ионов в лиотропных рядах может меняться вплоть до полного обращения.
