
- •11. Ароматическими углеводородами (аренами) называются вещества, в молекулах которых содержится одно или несколько бензольных колец — циклических групп атомов углерода с особым характером связей.
- •5.Номенклатура спиртов (5-7 минут)
- •6. Кассификация спиртов (10 минут)
- •Изомерия углеродного скелета
- •Изомерия положения функциональной группы
- •8.Физические свойства спиртов (5-7 минут)
- •Двухатомные спирты (алкандиолы, или гликоли)
- •18. Трехатомные спирты (алкантриолы, или глицерины)
- •19. 7. Альдегиды, кетоны
- •[Править]Номенклатура
- •[Править]Изомерия
- •[Править]Гомологический ряд
- •23. Ароматические карбоновые кислоты.
- •32. Классификация белков
- •35. Моносахариды. Альдозы. Кетозы. Открытая цепь и циклические формы углеводов.
- •Альдозы и кетозы
- •Открытая цепь и циклические формы углеводов
- •36. Строение
- •Изомерия обусловлена наличием:
- •Получение моносахаридов
- •Физические свойства
- •Химические свойства
- •Применение глюкозы
- •Фруктоза
- •37. Дисахариды
- •Получение дисахаридов
- •38. Полисахариды: крахмал, целлюлоза
- •Крахмал
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Целлюлоза, или клетчатка
- •Физические свойства
- •Состав и строение
- •Химические свойства. Применение целлюлозы
- •По наличию ароматичности
- •Физические свойства
- •Циклизация акролеина и аммиака
- •Аминирование пиридина (реакция Чичибабина)
- •Реакция с гидроксидом калия
8.Физические свойства спиртов (5-7 минут)
Если рассмотреть гомологический ряд спиртов, то можно увидеть нечто общее для них – то, что среди них нет газов (в отличие от углеводородов). Все спирты жидкости. А так как молекула спирта полярна из-за наличия ОН-группы, то атом кислорода обладает частично отрицательным зарядом, атом водорода – частично положительным. Атом кислорода одной молекулы спирта может взаимодействовать с атомом водорода другой молекулы, имеющим положительный заряд. Образуется водородная связь, которая обозначается …
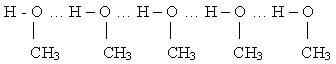
Задание: Изобразите образование водородных связей в молекулах пропанола-1.
Водородные связи менее прочные, чем ковалентные, примерно в 10 раз. Но их много, поэтому молекулы спирта оказываются как бы “прилипшими” между собой, т.е. ассоциированными. Вот почему все спирты имеют жидкую консистенцию.
Однако растворимость спиртов в воде разная. Чем это можно объяснить? (ответы учащихся)
Тем, что в состав разных спиртов входят разные углеводородные радикалы. Чем больше радикал, тем растворимость будет ниже, т.к. радикал отталкивается от воды. Гидроксильной группе такой большой молекулы трудно за счет образования водородных связей удержать ее в водной среде. Таким образом, спирты с большой молекулярной массой в воде будут растворяться хуже.
Этанол С2Н5ОН – бесцветная жидкость со своеобразным запахом, легче воды (р=0,8 г/мл), кипит при т=78,3оС, хорошо растворяется в воде и является сам растворителем многих неорганических и органических веществ.
Метанол СН3ОН – похож по свойствам на этанол, но это яд.
17.
Двухатомные спирты (алкандиолы, или гликоли)
Двухатомные спирты (гликоли) содержат в молекуле две гидроксильщ
группы при разных углеродных атомах.
<div style="height: 14px;overflow:hidden"><div style="margin-top: 14px;"><a href="http://chemistry.narod.ru/">Мир химии.</a></div></div>
Общая формула этих спиртов CnH2n(OH)2. Первым представителе двухатомных спиртов является этиленгликоль (этандиол) НОСН2—СН2ОН.
Номенклатура. Чтобы назвать эти спирты по систематической номенклатуре, к названию алкана добавляют суффикс -диол, а цифрам указывают место гидроксилов в углеродной цепи:
Н3С—СН2—СН—СН2ОН | ОН бутандиол-1,2
По рациональной номенклатуре названия двухатомных спиртов можно составить из названий соответствующих алкеновых углеводородов с добавлением слова гликоль:
НОСН2—СН2ОН НОСН2—СНОН—СН3 этиленгликоль пропиленгликоль (этандиол) (пропандиол-1,2)
Изомерия этих спиртов зависит от строения углеродной цепи и расположения в ней двух гидроксильных групп (a-, b-, g-гликоли и т.д.):
Н3С—СНОН—СН2ОН HOCH2—CH2—CH2OH пропандиол-1,2 пропандиол-1,3 (a-гликоль) (b-гликоль)
Получение. В методах получения двухатомных и одноатомных спиртов много общего. Так, двухатомные спирты можно получать:
1. Гидролизом дигалогенопроизводных:
Н3С—СН—СН2Сl + 2Н2О ® Н3С—СН—СН2ОН + 2HСl | | Сl ОН 1,2-дихлорпропан пропандиол-1,2
2. Окислением этиленовых углеводородов:
Н2С==СН2 + Н2О + O ® HOCH2—CH2OH этилен этиленгликоль
3. Гидратацией оксида этилена:
Н2С—CH2 +Н2О ® НОСН2—СН2ОН \ / O оксид этилена
Физические свойства. Низшие гликоли (от греч. glykys — сладкий) — сиропообразные, сладкие на вкус, растворимые в воде вещества. Гликоли кипят при более высокой температуре и имеют большую плотность, чем соответствующие им (с тем же числом углеродных атомов) одноатомные спирты. Это объясняется присутствием второй гидроксильной группы, что ведет к образованию дополнительных водородных связей.
Химические свойства. Двухатомные спирты в химических реакциях могут реагировать одной или двумя гидроксильными группами.
1. Образование гликолятов. В отличие от одноатомных спиртов двухатомные легко вступают во взаимодействие не только со щелочными металлами, но и с оксидами и гидроксидами тяжелых металлов. Образующиеся вещества называют гликолятами:
H | CH2OH H2C—O\ еO—CH2 2 | + Cu(OH)2 ® | Cu | + 2H2O CH2OH H2C—Oд \O—CH2 | H этилен- гликолят меди (комп- -гликоль лексное соединение)
2. Реакции дегидратации. Эти реакции, как известно, могут быть внутримолекулярными и межмолекулярными:
а) внутримолекулярная дегидратация:
H2C—CH—OH ® [H2C==CH—OH] ® H3C—C==O | | -H2O \ OH H H этилен- виниловый уксусный гликоль спирт альдегид
б) межмолекулярная дегидратация:
HOCH2—CH2OH + HOCH2—CH2OH ® HOCH2—CH2—O—CH2—CH2OH -H2O диэтилентликоль
В случае (б) процесс может идти и дальше — с образованием полимера:
nHOCH2—CH2OH ® [—CH2—CH2—O—]n + nH2O
При межмолекулярной дегидратации образуются не только линейные но и циклические продукты:
/O\ H2C—OH HO—C H2C CH2 | + | ® | | + 2H2O H2C—OH HO—CH2 H2C CH2 \O/ 1,4-диоксан
Диоксан используют в качестве растворителя (осторожно: токсичен).
3. Образование простых и сложных эфиров. Взаимодействуя спиртами или кислотами (органическими или неорганическими), гликоли образуют простые и сложные эфиры:
H+ HOCH2—CH2OH + HO—C2H5 —® HOCH2—CH2—O—C2H5 + H2O этилцеллозольв (простой эфир)
H2C—OH H+ H2C—O—NO2 | + 2HNO3 —® | + 2H2O H2C—OH H2C—O—NO2 динитроэти- ленгликоль (сложный эфир)
4. Замена гидроксильных групп на галоген:
H2C—OH H2C—Cl | + HCl ® | + H2O H2C—OH H2C—Cl этилен- хлоргидрин
Окисление. При окислении двухатомные спирты образуют ряд промежуточных продуктов. Например, при окислении этиленгликоля образуются: гликолевый альдегид (НОСН2—СНО), глиоксаль (ОНС—СНО), гликолевая кислота (НОСН2—СООН), глиоксалевая кислота (ОНС—СООН) и щавелевая кислота (HOOС—COOH). Щавелевая кислота обычно является предпоследним продуктом окисления многих органических соединений.
