
- •11. Ароматическими углеводородами (аренами) называются вещества, в молекулах которых содержится одно или несколько бензольных колец — циклических групп атомов углерода с особым характером связей.
- •5.Номенклатура спиртов (5-7 минут)
- •6. Кассификация спиртов (10 минут)
- •Изомерия углеродного скелета
- •Изомерия положения функциональной группы
- •8.Физические свойства спиртов (5-7 минут)
- •Двухатомные спирты (алкандиолы, или гликоли)
- •18. Трехатомные спирты (алкантриолы, или глицерины)
- •19. 7. Альдегиды, кетоны
- •[Править]Номенклатура
- •[Править]Изомерия
- •[Править]Гомологический ряд
- •23. Ароматические карбоновые кислоты.
- •32. Классификация белков
- •35. Моносахариды. Альдозы. Кетозы. Открытая цепь и циклические формы углеводов.
- •Альдозы и кетозы
- •Открытая цепь и циклические формы углеводов
- •36. Строение
- •Изомерия обусловлена наличием:
- •Получение моносахаридов
- •Физические свойства
- •Химические свойства
- •Применение глюкозы
- •Фруктоза
- •37. Дисахариды
- •Получение дисахаридов
- •38. Полисахариды: крахмал, целлюлоза
- •Крахмал
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Целлюлоза, или клетчатка
- •Физические свойства
- •Состав и строение
- •Химические свойства. Применение целлюлозы
- •По наличию ароматичности
- •Физические свойства
- •Циклизация акролеина и аммиака
- •Аминирование пиридина (реакция Чичибабина)
- •Реакция с гидроксидом калия
11. Ароматическими углеводородами (аренами) называются вещества, в молекулах которых содержится одно или несколько бензольных колец — циклических групп атомов углерода с особым характером связей.
Понятие “бензольное кольцо” требует расшифровки. Для этого необходимо рассмотреть строение молекулы бензола. Первая структура бензола была предложена в 1865г. немецким ученым А. Кекуле:
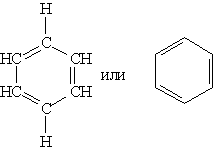
Эта формула правильно отражает равноценность шести атомов углерода, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, бензол не проявляет склонности к реакциям присоединения: он не обесцвечивает бромную воду и раствор перманганата калия, т. е. не дает типичных для непредельных соединений качественных реакций.
Особенности строения и свойств бензола удалось полностью объяснить только после развития современной квантово-механической теории химических связей. По современным представлениям все шесть атомов углерода в молекуле бензола находятся в sp2-гибридном состоянии. Каждый атом углерода образует -связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Валентные углы между тремя -связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник ( -скелет молекулы бензола).
Каждый атом углерода имеет одну негибридизованную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскому -скелету и параллельно друг другу (см. рис. а). Все шесть электронов взаимодействуют между собой, образуя -связи, не локализованные в пары как при образовании двойных связей, а объединенные в единое -электронное облако. Таким образом, в молекуле бензола осуществляется круговое сопряжение. Наибольшая -электронная плотность в этой сопряженной системе располагается над и под плоскостью -скелета (см. рис. б).

В результате все связи между атомами углерода в бензоле выровнены и имеют длину 0,139нм. Эта величина является промежуточной между длиной одинарной связи в алканах (0,154нм) и длиной двойной связи в алкенах (0,133 им). Равноценность связей принято изображать кружком внутри цикла (см. рис. в). Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Эта величина составляет энергию сопряжения — количество энергии, которое нужно затратить, чтобы нарушить ароматическую систему бензола.
Такое электронное строение объясняет все особенности бензола. В частности, понятно, почему бензол трудно вступает в реакции присоединения, — это привело бы к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
Номенклатура и изомерия. Условно арены можно разделить на два ряда. К первому относят производные бензола (например, толуол или дифенил), ко второму — конденсированные (полиядерные) арены (простейший из них — нафталин):

Гомологический ряд бензола отвечает общей формуле С6Н2n-6.
Структурная изомерия в гомологическом ряду бензола обусловлена взаимным расположением заместителей в ядре. Монозамещенные производные бензола не имеют изомеров положения, так как все атомы в бензольном ядре равноценны. Дизамещенные производные существуют в виде трех изомеров,

различающихся взаимным расположением заместителей. Положение заместителей указывают цифрами или приставками: орто- (о-), мета- (м-), пара- (п-).
Радикалы ароматических углеводородов называют арильными радикалами. Радикал С6Н5 — называется фенил.
Физические свойства. Первые члены гомологического ряда бензола (например, толуол, этилбензол и др.) — бесцветные жидкости со специфическим запахом. Они легче воды и нерастворимы в ней. Хорошо растворяются в органических растворителях. Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Способы получения.
1. Получение из алифатических углеводородов. При пропускании алканов с неразветвленной цепью, имеющих не менее шести атомов углерода в молекуле, над нагретой платиной или оксидом хрома происходитдегидроциклизация — образование арена с выделением водорода:
![]()
2. Дегидрирование циклоалканов. Реакция происходит при пропускании паров циклогексана и его гомологов над нагретой платиной:

3. Получение бензола тримеризацией ацетилена.
4. Получение гомологов бензола по реакции Фриделя—Крафтса (см. далее).
5. Сплавление солей ароматических кислот со щелочью:
![]()
Химические свойства. Обладая подвижной шестеркой -электронов, ароматическое ядро является удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное расположение -электронного облака с двух сторон плоского -скелета молекулы (см. рис. б).
Для аренов наиболее характерны реакции, протекающие по механизму электрофильного замещения,обозначаемого символом SE (от англ. substitution electrophilic).

Механизм электрофильного замещения можно представить следующим образом. Электрофильный реагент XY (X является электрофилом) атакует электронное облако, и за счет слабого электростатического взаимодействия образуется неустойчивый -комплекс. Ароматическая система при этом еще не нарушается. Эта стадия протекает быстро. На второй, более медленной стадии формируется ковалентная связь между электрофилом Х и одним из атомов углерода кольца за счет двух -электронов кольца. Этот атом углерода переходит из sр2- в sр3-гибридное состояние. Ароматичность системы при этом нарушается. Четыре оставшиеся -электрона распределяются между пятью другими атомами углерода, и молекула бензола образует карбокатион, или -комплекс.
Нарушение ароматичности энергетически невыгодно, поэтому структура -комплекса менее устойчива, чем ароматическая структура. Для восстановления ароматичности происходит отщепление протона от атома углерода, связанного с электрофилом (третья стадия). При этом два электрона возвращаются в -систему и тем самым восстанавливается ароматичность:

Реакции электрофильного замещения широко используются для синтеза многих производных бензола.
Химические свойства бензола. 1. Галогенирование. Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только в присутствии катализаторов — безводных АlСl3, FeСl3, АlВr3. В результате реакции образуются галогенозамещенные арены:

Роль катализатора заключается в поляризации нейтральной молекулы галогена с образованием из нее электрофильной частицы:
![]()
2. Нитрование. Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии так называемой нитрующей смеси (смесь концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:
![]()
3. Сулъфирование. Реакция легко проходит под действием “дымящей” серной кислоты (олеума):
![]()
4. Алкилирование по Фриделю—Крафтсу. В результате реакции происходит введение в бензольное ядро алкильной группы с получением гомологов бензола. Реакция протекает при действии на бензол галогеналканов RСl в присутствии катализаторов — галогенидов алюминия. Роль катализатора сводится к поляризации молекулы RСl с образованием электрофильной частицы:
![]()
В зависимости от строения радикала в галогеналкане можно получить разные гомологи бензола:
![]()
5. Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола и изопропилбензола (кумола). Алкилирование проводят в присутствии катализатора АlСl3. Механизм реакции сходен с механизмом предыдущей реакции:
![]()
Все рассмотренные выше реакции протекают по механизму электрофильного замещения SE.
Реакции присоединения к аренам приводят к разрушению ароматической системы и требуют больших затрат энергии, поэтому протекают только в жестких условиях.
6. Гидрирование. Реакция присоединения водорода к аренам идет при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензол превращается в циклогексан, а гомологи бензола — в производные циклогексана:
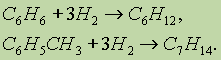
7. Радикальное галогенирование. Взаимодействие паров бензола с хлором протекает по радикальному механизмутолько под воздействием жесткого ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт — гексахлорциклогексан (гексахлоран) С6Н6Сl6:

8. Окисление кислородом воздуха. По устойчивости к действию окислителей бензол напоминает алканы. Только при сильном нагревании (400 °С) паров бензола с кислородом воздуха в присутствии катализатора V2О5 получается смесь малеиновой кислоты и ее ангидрида:

Химические свойства гомологов бензола. Гомологи бензола имеют целый ряд особых химических свойств, связанных со взаимным влиянием алкильного радикала на бензольное кольцо, и наоборот.
Реакции в боковой цепи. По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген по свободно-радикальному механизму. Поэтому в отсутствие катализатора при нагревании или УФ-облучении идет радикальная реакция замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с бензольным кольцом ( -атома углерода).
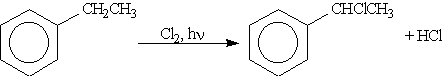
Замещение в бензольном кольце возможно только по механизму SE в присутствии катализатора АlСl3:
![]()
При действии на гомологи бензола перманганата калия и других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением -атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:

Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:

Правила ориентации (замещения) в бензольном кольце.
Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
В молекулах, имеющих только -связи, взаимное влияние атомов осуществляется через индуктивный эффект. В молекулах, представляющих собой сопряженные системы, проявляется действие мезомерного эффекта.
Влияние заместителей, передающееся по сопряженной системе -связей, называется мезомерным (М) эффектом.
В молекуле бензола -электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя.
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные.
Электронодонорные заместители проявляют +М- и +I-эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа —ОН и аминогруппа —NН2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с -электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредоточивается в орто- ипара-положениях:
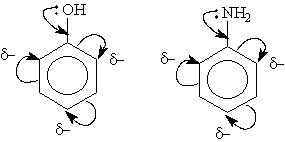
Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +I-эффект, под действием которого происходит аналогичное перераспределение -электронной плотности.
Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе. К ним относятся нитрогрупла —NO2, сульфогруппа —SO3Н, альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается в мета-положениях:
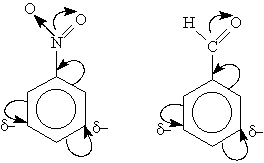
Полностью галогенизированные алкильные радикалы (например, —ССl3) проявляют -I-эффект и такжеспособствуют понижению электронной плотности кольца.
Закономерности преимущественного направления замещения в бензольном кольце называют правилами ориентации.
Заместители, обладающие +I-эффектом или +М-эффектом, способствуют электрофильному замещению в орто- ипара-положениях бензольного кольца и называются заместителями (ориентантами) первого рода:
![]()
Заместители, обладающие -I-эффектом или -М-эффектом, направляют электрофильное замещение вмета-положения бензольного кольца и называются заместителями (ориентантами) второго рода:
![]()
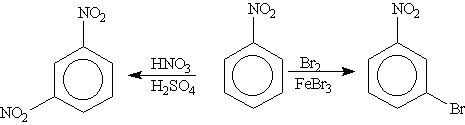
Так, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и орто-положения:

Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение:
Помимо ориентирующего действия заместители оказывают влияние и на реакционную способность бензольногокольца: ориентанты 1-го рода (кроме галогенов) облегчают вступление второго заместителя;ориентанты 2-го рода (и галогены) затрудняют его.
Применение. Бензол и его гомологи применяются как химическое сырье для производства лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ. Широко используются как растворители. Бензол в качестве добавки улучшает качество моторного топлива.
12. 1. ГАЛОГЕНОПРОИЗВОДНЫЕ Производные углеводородов, в молекулах которых один или несколько атомов водорода замещены галогеном. Их общая формула: R – X где R – углеводородный радикал; X = F , Cl , Br или I . Если R = С n Н 2 n +1 , т. е. является алкильным радикалом, то галогенопроизводные называются алкилгалогенидами или галогеналканами.
2. ГАЛОГЕНОПРОИЗВОДНЫЕ ИЗОМЕРИЯ R – X . НОМЕНКЛАТУРА Изомерия C n H 2 n +1 X обусловлена: а) изомерией углеродного скелета; б) положением галогена; Х – С–С–С–С–С– – С–С–С–С– Х–С– а) б) Х – С–С–С–С–С– Х – С–С–С–С–С–
3. ГАЛОГЕНОПРОИЗВОДНЫЕ НОМЕНКЛАТУРА R – X Причем название X ставится либо перед, либо после названия радикала: Рациональная номенклатура название радикала R название галогена X + = 1. хлористый метил (метилхлорид) СН 3 С l бромистый пропил (пропилбромид) СН 3 – СН 2 – СН 2 – Br
4. ГАЛОГЕНОПРОИЗВОДНЫЕ 2. Заместительная номенклатура: 4-метил-2-хлорпентан CH 3 CI СН 3 –СН–СН 2 – СН–СН 3 5 4 3 2 1 3-метил-1хлор-2-этилпентан-3 1 СН 2 Cl H 3 C СН 3 –СН = С – СН–СН 2 –СН 3 2 3 4 5
5. ГАЛОГЕНОПРОИЗВОДНЫЕ АРИЛГАЛОГЕНИДЫ Общая формула Ar – X ; в этих соединениях галоген непосредственно связан с атомом углерода ароматического кольца ( поэтому мало подвижен !!): бромбензол Br 1-бром-3-метилбензол (М-бромтолуол) Br С H 3
6. ГАЛОГЕНОПРОИЗВОДНЫЕ МЕТОДЫ СИНТЕЗА R – X (звездочкой (*) отмечены методы, используемые также в промышленности). 1. Из спиртов: действием галогеноводородов (НХ) и галогенидов фосфора (РХ): Общая схема: R – OH R – X спирт алкилгалогенид НХ или РХ 3 ,PX 5
7. ГАЛОГЕНОПРОИЗВОДНЫЕ МЕТОДЫ СИНТЕЗА R – X . ПРИМЕРЫ: СН 3 СН 2 O Н СН 3 СН 2 Br конц. Н Br , t C или ( NaBr + H 2 SO 4 ) этанол бромистый этил 3С 2 Н 5 ОН + РС l З 3 C 2 H 5 Cl + P ( OH ) 3 2*. Галогенирование углеводородов: R–H + X 2 R–X + HX алкан (X = Cl, Br)
8. ГАЛОГЕНОПРОИЗВОДНЫЕ 3*. Присоединение галогеноводородов к алкенам: 4*. Присоединение галогенов к алкенам и алкинам: Х 2 Х Х – С – С – – С = С – Н– С ≡ С –Н Н– СХ 2 – СХ 2 –Н Х 2 алкен HX Х H – С – С – – С = С –
9. ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕ Промышленные способы: 1.1. Галогенирование алканов (обычно образуются смеси изомеров, что несколько снижает ценность метода): 1.2. Присоединение галогеноводородов и галогенов к алкенам и алкинам: НС≡СН СН 2 =СН–С l HCl , HgCl 2 ацетилен хлористый винил t 0 C CI 2 метан CI 2 CCl 4 CHCl 3 CH 2 Cl 2 CH 3 Cl CH 4 CI 2 CI 2 t 0 C t 0 C
10. Cl 2 500 C хлористый винил этилен СН 2 =СН–С l СН 2 = СН 2 СН 2 – СН 2 С l С l 1.3. Фторопроизводные получают из других галогено-производных при помощи неорганических фторидов: полифториды: 2СН 3 Cl + Hg 2 F 2 2 CH 3 F + Hg 2 Cl 2 C 7 F 16 + 16HF + 32CoF 2 C 7 H 16 + 32CoF 3 ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕ
11. ГАЛОГЕНОПРОИЗВОДНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА R – X Температура плавления и кипения R – X Температура плавления и кипения R – H > 1. 2. При данном R температура кипения повышается в ряду: R–F R–Cl R–Br R–I ? 3. Растворимость R – X : хотя R – X – полярные соединения, они нерастворимы в воде ( почему ? ), но хорошо растворимы в обычных органических растворителях. ?
12. ГАЛОГЕНОПРОИЗВОДНЫЕ РАСТВОРИМОСТЬ: ОБЩИЕ ЗАКОНОМЕРНОСТИ Компонент А Компонент В 1. Е А∙∙∙ A > Е A ∙∙∙ B нет растворения 2. Е B ∙∙∙ B > Е A ∙∙∙ B нет растворения 3. Е A ∙∙∙ A Е A ∙∙∙ B Е B ∙∙∙ B есть растворение Старинное правило: «ПОДОБНОЕ РАСТВОРЯЕТСЯ В ПОДОБНОМ» ( Растворяемое вещество ) ( Растворитель ) ЭНЕРГИЯ СВЯЗЕЙ Е:
13. ГАЛОГЕНОПРОИЗВОДНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА R – X Характерной чертой RX является наличие группировки: : .. .. δ- δ + – C – X Анализ строения позволяет отметить следующее: 1. функциональная группа не имеет кратных связей, поэтому несклонна к реакциям присоединения; 2. галогены как элементы более электроотрица-тельные, чем углерод, создают на связанном с ними атоме углерода частичный положительный заряд ( + ).
14. ГАЛОГЕНОПРОИЗВОДНЫЕ « S » - от слова « substitution » - замещение; « N » - от слова « nucleophilic ». В S N – реакциях происходит атака нуклеофила : Nu (т.е. реагента, предоставляющего электронную пару) на атом углерода с вытеснением галогена в виде : X – R : Nu + : X – Nu : + R : X ХИМИЧЕСКИЕ СВОЙСТВА R – X Отмеченные обстоятельства заставляют предполо-жить: Наиболее характерными реакциями галогено-производных будут реакции нуклео-фильного замещения ( S N – реакции).
15. МЕХАНИЗМ РЕАКЦИИ В зависимости от природы галогено-производного (R – X ), нуклеофильного реагента ( : Nu ) и условий реакции (растворитель, температура) процессы нуклеофильного замещения могут идти по двум механизмам: S N 1 или S N 2. НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ:
16. Рассмотрим реакцию между трет-бутилбромидом и гидроксид-ионом: трет-бутилбромид трет-бутанол CH 3 CH 3 CH 3 – C – OH + : Br – CH 3 CH 3 СН 3 – С – Br + : OH – Известно (экспериментальный факт!), что скорость этой реакции зависит от концентрации только одного реагента - трет-бутилбромида: = К (СН 3 ) 3 С Br ХИМИЧЕСКИЕ СВОЙСТВА R – X S N – реакция: механизм и кинетика.
17. Возникает вопрос , почему скорость реакции не зависит от концентрации гидроксид-иона : ОН – ? Ответ: Если скорость реакции не зависит от ОН – , это может означать только то, что гидроксид-ион не участвует в реакции, скорость которой определяют. ХИМИЧЕСКИЕ СВОЙСТВА R – X S N – РЕАКЦИЯ: МЕХАНИЗМ И КИНЕТИКА.
18. (СН 3 ) 3 С + + :ОН – (СН 3 ) 3 С–ОН 2. Вторая стадия: быстрая Отсюда можно предположить следующий механизм реакции: CH 3 CH 3 CH 3 – C – Br CH 3 CH 3 CH 3 – C + + : Br – 1. Медленная стадия (лимитирующая скорость):
19. Первая стадия – ионизация реагента и образование карбкатиона (протекает медленно) Вторая стадия – взаимодействие карбкатиона с нуклеофильной частицей (идет быстро) медленно 2. R + :Nu R : Nu быстро + – + S N 1-ЗАМЕЩЕНИЕ МЕХАНИЗМ РЕАКЦИИ. ОБЩИЙ ВИД: – 1. R : X R + :X + – + –
20. Скорость S N 1 – реакции зависит только от концентра-ции алкилгалогенида, т. е. S N 1 – реакция является реакцией первого порядка: = k RX Скорость общей реакции определяется первой (медленной) стадией: как быстро ионизируется RX . Порядком реакции по данному реагенту называют степень в которой его концентрация входит в уравнение скорости реакции; общий порядок равен сумме этих степеней. S N 1-ЗАМЕЩЕНИЕ МЕХАНИЗМ РЕАКЦИИ. ОБЩИЙ ВИД:
21. СН 3 Br + :ОН – СН 3 ОН + :Br Рассмотрим теперь реакцию бромистого метила с гидроксид-ионом, приводящую к метиловому спирту: ХИМИЧЕСКИЕ СВОЙСТВА R – X S N – РЕАКЦИЯ: МЕХАНИЗМ И КИНЕТИКА. ‒ Кинетические данные для этой реакции показывают, что скорость реакции в этом случае зависит от концентрации обоих реагентов и выражается кинетическим уравнением второго порядка: = К [НО: ֿ ][СН 3 Br ] Это бимолекулярное нуклеофильное замещение или S N 2 -реакция
22. МЕХАНИЗМ S N 2- РЕАКЦИИ (бимолекулярное нуклеофильное замещение) S N 2 – реакция – одностадийный процесс, в ходе которого присоединение нуклеофила : OH – и удале-ние уходящей группы : Br – происходит одновременно. В ходе реакции возникает переходное состояние с пятивалентным атомом углерода : H H H HO – C + : Br – δ – δ – H H H HO ∙∙∙ C ∙∙∙ Br H H H HO : + С– Br – углерод связан с пятью группами; заряд распре-делен между выступающей и уходящей группами переходное состояние:
23. S N 2-ЗАМЕЩЕНИЕ МЕХАНИЗМ РЕАКЦИИ. ОБЩИЙ ВИД: S N 2 – реакция – одностадийный процесс, в ходе которого присоединение нуклеофила : Nu – и удаление уходящей группы : X – происходит одновременно. В ходе реакции возникает переходное состояние с пятивалентным атомом углерода : Nu – C – + : X – δ - δ - Nu ∙∙∙ C ∙∙∙ X Nu : – переходное состояние: углерод связан с пятью группами; заряд распре- делен между выступающей и уходящей группами – С – X
24. Роль нуклеофильного реагента могут играть как анионы, так и нейтральные частицы. Характер действия каждого их них иллюстрируется следующими уравнениями: 1. R–X + : Nu – R–Nu + : X – 2. R–X + : Nu R–Nu + : X 3. R–X + H–Nu : R–Nu + –H + : X – R–Nu : + HX ПРИРОДА НУКЛЕОФИЛЬНОГО РЕАГЕНТА:
25. ПРИМЕРЫ НУКЛЕОФИЛОВ: а) Анионы: НО – (гидроксил-анион) RO – (алкоголят-ионы) RCOO – (ионы органических кислот) С N – (цианид-ион) б) Нейтральные молекулы: Н 2 О, NH 3 .. .. .. и их производные ROR, NH 2 R , NHR 2 , NR 3 – нуклеофильные свойства нейтральных молекул обусловлены свободной электронной парой. .. .. .. ..
26. ГАЛОГЕНОПРОИЗВОДНЫЕ С 2 H 5 Cl + KOH C 2 H 5 OH + KCl CH 3 CH 2 Cl + H 2 O CH 3 CH 2 OH + HCl этилхлорид этанол НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ: примеры реакций + - + –
27. ОБШАЯ СХЕМА: R : X + : Nu R : Nu + : X – 1. R : X + : ОН – R : OH + : X – спирт 2. R : X + Н 2 О : R : OH + H : X спирт 3. R : X + - : OR′ R : OR′ + : X – простой эфир НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ: ПРИМЕРЫ РЕАКЦИЙ
28. 4. R : X + – : С ≡ С R′ R : C ≡ CR′ + : X – алкин 5. R : X + Na : R′ R : R′ + : X – алкан 6. R : X + : I – R : I + : X – иодистый алкил 7. R : X + : CN – R : CN + : X – нитрил 8. R : X + R′COO : – R′COO : R + : X – сложный эфир НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ: ПРИМЕРЫ РЕАКЦИЙ
29. 9. R : X+ : NH 3 R : NH 3 + : X – R–NH 2 амин 10. R : X + : NH 2 R′ R : NH 2 R′ + X – RNHR ′ + Н X алкилбензол реакция Фриделя – Крафтса: 11. R : X + ArH Ar – R AlCl 3 арен 12. и др. … НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ: ПРИМЕРЫ РЕАКЦИЙ вторичный амин : NH3
30. ДРУГИЕ РЕАКЦИИ ГАЛОГЕНОПРОИЗВОДНЫХ 2) Дегидрогалогенирование: отщепление КОН (спирт) – С = С – + НХ Х H – С – С – 3) Синтез реактива Гриньяра: RX + Mg RMgX эфир
31. СТЕРЕОХИМИЯ S N 1-Реакций 1.Первая стадия: ионизация галогенопроизвод-ного ( медленная стадия ). карбкатион (плоская конфигурация) + : X – R R R 1 3 2 C + C – X R R R 1 3 2
32. рацемат 2. Вторая стадия ( быстрая ): подход нуклеофила возможен с любой стороны плоскости. СТЕРЕОХИМИЯ S N 1-Реакций + :Nu – R R R 1 3 2 C + C – Nu R R R 1 3 2 Nu – C R R R 1 3 2
33. повторение пройденного 1. расположение связей тетраэдрическое карбкатион расположение связей: плоское треугольное + C + : X – – С – X рацемат (равномолекулярная) смесь оптических антиподов 2. СТЕРЕОХИМИЯ S N 1- Реакций + C + : Nu – С – Nu Nu – C –
34. Скорость S N 1 – реакции определяется кинетическим уравнением первого порядка, т. е. зависит только от концентрации RX: = К (СН 3 ) 3 С– Cl 1. 2. КИНЕТИКА S N 1-Реакций повторение пройденного (СН 3 ) 3 С–ОН (СН 3 ) 3 С + : ОН – + ( CH 3 ) 3 C + : Cl – ; CH 3 CH 3 СН 3 –С–С l +
35. СТЕХЕОХИМИЯ S N 1 – РЕАКЦИЙ Конечный продукт S N 1 – реакции представляет собой смесь оптических антиподов – рацемат. Образование рацемата можно представить из схемы:
36. подход нуклеофила возможен с любой стороны плоского карбкатиона : Nu ‒ СТЕХЕОХИМИЯ S N 1 – РЕАКЦИЙ R′′ R′ R′″ C + R″ R′ R″′ C Nu Nu C R′ R″ R″′
37. СТЕРИЧЕСКИЕ (ПРОСТРАНСТВЕННЫЕ) ЗАТРУДНЕНИЯ S N 2 – РЕАКЦИИ X CH 3 CH 3 CH 3 Nu : C переходное состояние Nu – C – + : X – δ - δ - Nu ∙∙∙ C ∙∙∙ X Nu : – + – С – X
38. Выше отмечалось, что S N 1 – реакция – двухстадийный процесс, общая скорость которого определяется лимитирующей стадией, т. е. стадией образования карбкатиона: 1. R:X R + + :X – 2. R + + : Nu – R : Nu медленно быстро Поэтому реакционная способность RX изменяется в том же направлении, что и устойчивость карбкатионов. S N 1 – МЕХАНИЗМ : РЕАКЦИОННАЯ СПОСОБНОСТЬ
39. Реакционная способность RX в S N 1 – реакции уменьшается в ряду: Такой порядок реакционной способности RX соответст-вует ряду изменения устойчивости карбкатионов: S N 1 – МЕХАНИЗМ : РЕАКЦИОННАЯ СПОСОБНОСТЬ метил-катион первичный вторичный третичный > > CH 3 H CH 3 C + H H CH 3 C + CH 3 C + CH 3 CH 3 > H H H C + > > R R R C R H R C H H R C X X X > CH 3 X
40. ГАЛОГЕНОПРОИЗВОДНЫЕ Механизм SN 2 (бимолекулярное нуклеофильное замещение) SN 2 – реакция – одностадийный процесс, в ходе которого присоединение нуклеофила : Nu – и удаление уходящей группы : X – происходит одновременно. В ходе реакции возникает переходное состояние с пятивалентным атомом углерода : Nu – C – + : X – δ - δ - Nu ּּּ C ּּּ X – С – X Nu : – переходное состояние: углерод связан с пятью группами; заряд распределен между вступающей и уходящей группами
41. ГАЛОГЕНОПРОИЗВОДНЫЕ Такой механизм согласуется с данными по кинетике, стереохимиии и реакционной способности процесса: 1. Кинетические данные: В качестве примера рассмотрим реакцию бромистого метила с гидроксид-ионом, приводящую к метиловому спирту: H H H HO – C + : Br – δ – δ – H H H HO ∙∙∙ C ∙∙∙ Br H H H HO : + С– Br –
42. ГАЛОГЕНОПРОИЗВОДНЫЕ В решающей стадии реакции участвуют оба реагента и НО : – и СН 3 Br , следовательно скорость реакции должна быть пропорциональна концентрации обоих реагентов: = К [НО: ֿ ][СН 3 Br ] (кинетическое уравнение второго порядка) Эксперименты показывают, что это действительно так, т. е. SN 2 – реакция имеет второй порядок.
43. 2. СТЕРЕОХИМИЯ S N 2 – ЗАМЕЩЕНИЯ: Изучение S N – реакций на примере оптически активных алкилгалогенидов (и др. веществ) показало, что в том случае, когда реакция имеет второй порядок (т. е. вслучае S N 2 – замещения) конечный продукт имеет конфигурацию противоположную конфигурации исходного вещества (является оптическим антиподом). Процесс обращения конфигурации можно сравнить с выворачиванием зонтика от сильного ветра. Роль «ветра» здесь играет нуклеофил : Nu – , роль «спиц»- валентные связи: ВАЛЬДЕНОВСКОЕ ОБРАЩЕНИЕ (П. Вальден, кон. XIX в.).
44. R 1 R 2 R 3 − Br Nu : – R 1 R 2 R 3 + : Br – Nu ― δ- ∙∙∙ Br R 1 R 2 R 3 Nu ∙∙∙ δ- Обращение конфигурации в S N 2 – реакциях указыва-ет на то, что нуклеофил атакует молекулу с тыла, т. е. со стороны, противоположной той, где находится галоген. Если бы нуклеофил атаковал молекулу с той же стороны, где находится галоген (фронтальная атака), то обращение конфигурации не наблюдалось бы. Это наглядно видно на примере взаимодействия гидроксид-иона с цис-3-метилциклопентилхлоридом: 2. СТЕРЕОХИМИЯ S N 2 – ЗАМЕЩЕНИЯ:
45. S N 2 – РЕАКЦИЯ: ОБРАЩЕНИЕ КОНФИГУРАЦИИ цис -спирт (не образуется) транс-спирт фронтальная атака атака с тыла CH 3 H H CI OH - CH 3 H H OH H H CH 3 OH
46. 3. Данные по реакционной способности: В S N 2 – реакциях реакционная способность RX уменьшается в следующем порядке: Для объяснения данной закономерности нужно рассмотреть влияние пространственных факторов в реакциях S N 2 – замещения: S N 2 – РЕАКЦИЯ > > > R H R C X R R R C X H H R C X CH 3 X
47. Пространственные факторы в S N 2 – реакциях. этил метил трет-бутил изопропил H CH 3 Х H Nu H H Х H Nu CH 3 CH 3 Х H Nu CH 3 CH 3 Х CH 3 Nu
48. Увеличение числа алкильных заместителей создает пространственные препятствия для приближения атакующего реагента с тыльной стороны. Более объемным заместителям труднее разместиться вокруг центрального углерода, это повышает энергию переходного состояния и замедляет реакцию. Пространственные факторы в S N 2 – реакциях.
49. ВЛИЯНИЕ СТРУКТУРНЫХ ФАКТОРОВ И ПРИРОДЫ РАСТВОРИТЕЛЯ В S N 2 – РЕАКЦИЯХ Механизму S N 1 способствуют: 1) Большой объем заместителей (центральный углерод третичный или вторичный). 2) Растворитель с большой диэлектрической постоянной. 3) Малоактивный нуклеофильный реагент. 4) Легко уходящая группа X. Механизму S N 2 способствуют: 1) Малый объем заместителей (центральный углерод первичный или вторичный). 2) Растворитель с малой диэлектрической постоянной. 3) Активный нуклеофильный реагент. 4) Трудно уходящая группа X.
50. ВЛИЯНИЕ АЛКИЛЬНОГО РАДИКАЛА : Полезно правило: первичные алкил - галогениды реагируют по механизму S N 2, а третичные – по механизму S N 1.
51. ГАЛОГЕНОПРОИЗВОДНЫЕ Скорость SN 2 – реакции возрастает Скорость SN 1 – реакции возрастает RX = CH X , первичный, вторичный, третичный
52. СРАВНЕНИЕ СКОРОСТЕЙ РЕАКЦИЙ S N 1 И S N 2 RBr + I – RI + : Br – (S N 2) RBr + H 2 O : ROH + Н Br (S N 1) R Относительная скорость S N 2 - реакции Относительная скорость S N 1 - реакции – CH 3 145 1,05 – CH 2 CH 3 1 1 – CH(CH 3 ) 2 8•10 ֿ 3 12 – C(CH 3 ) 3 5•10 ֿ 4 1,2•10 5
53. Нуклеофил – частица, предоставляющая электронную пару другому атому: S N - РЕАКЦИИ НЕКОТОРЫЕ ОПРЕДЕЛЕНИЯ: нуклеофил атакует электронодефицитный участок другой молекулы Основание – частица, предоставляющая электронную пару для связывания протона (Н + ): А: – + Н А – Н кислота, сопряженная основанию :А – основание δ+ δ- X – Y Nu :
54. Общее: и нуклеофил, и основание – доноры электронных пар. НУКЛЕОФИЛ И ОСНОВАНИЕ Различие: если электронной парой частицы атакуется углерод, то частицу называют «нуклеофилом», если протон – «основанием». Вывод: термины «нуклеофил» и «основание» могут быть использованы для описания одних и тех же частиц, но участвующих в различных реакциях :
55. нуклеофил .. .. – HO : .. .. .. .. – H–O–C + : Br : .. С –Br : .. НУКЛЕОФИЛ И ОСНОВАНИЕ основание H–O–H + : O –C .. .. – .. .. H–O–C .. .. H–O – .. ..
56. НУКЛЕОФИЛЬНОСТЬ И ОСНОВНОСТЬ: Нуклеофильность частицы – способность к взаимодействию за счет своей электронной пары с атомом углерода. Основность частицы – способность связывать протон за счет своей электронной пары. Основность частицы можно оценить по константе диссоциации кислоты, сопряженной данному основанию:
57. А – + Н + Н – А сопряженное основание Правило: Чем сильнее кислота, тем слабее сопря-женное ей основание и, наоборот, сильному основанию соответствует слабая сопряженная кислота: Сила кислот: H–F < H–Cl < H–Br < H–I Сила оснований: : F – > : Cl – > : Br – > : I – сопряженн ая кислота СОПРЯЖЕННАЯ КИСЛОТА И ОСНОВАНИЕ
58. ГАЛОГЕНОПРОИЗВОДНЫЕ Нуклеофильность реагентов не всегда изменяется параллельно их основности: нуклеофильность растет: F – , Cl – , Br – , I – основность растет: Нуклеофильность частицы (аниона) зависит от двух свойств: основности и поляризуемости: нуклеофильность = f (основность, поляризуемость)
59. ГАЛОГЕНОПРОИЗВОДНЫЕ Правило: 1. Если атакующий атом один и тот же, то нуклеофильность аниона прямо пропорцио-нальна его основности: < < НО : – СН 3 – О : – СН 3 – С – О : – основность и нуклеофильность растут 2. Если атакующие атомы (нуклеофильные центры) различны по природе, то нуклео-фильность пропорциональна их поляризуемо-сти: O
60. ГАЛОГЕНОПРОИЗВОДНЫЕ нуклеофильность растет (основность падает) : F – , : Cl – , : Br – , : I – поляризуемость растет Поляризуемость электронов – способность электронов смещаться под воздействием внешнего электрического поля (деформация внешней электронной оболочки). Поляризуемость растет с увеличением радиуса частицы (атома, иона) и уменьшением его заряда.
61. ГАЛОГЕНОПРОИЗВОДНЫЕ Наименее прочно удерживаются несвязывающие электроны, откуда следует, что атом, выступая в качестве нуклеофила, использует, как правило, несвязывающие электроны: порядок нуклеофильности: несвязывающие электроны σ–связывающие электроны π–связывающие электроны >> >> Природа уходящей группы X Правило: Хорошие уходящие группы, покидая молекулу, обозначают устойчивые ионы. Плохие уходящие группы образуют нестойкие ионы.
62. ГАЛОГЕНОПРОИЗВОДНЫЕ Из этого правила следует: сильные основания обычно бывают плохими уходящими группами; слабые основания обычно являются хорошими уходящими группами, т. е. [Существует обратное соотношение между основностью частицы и ее способностью быть уходящей группой.] основность растет: F – , Cl – , Br – , I – способность быть уходящей группой растет:
63. ГАЛОГЕНОПРОИЗВОДНЫЕ плохие уходящие группы (сильные основания): :ОН – , RO : – , : NH 2 – , : CH 3 – , : H – хорошие уходящие группы (слабые основания): R–SO 3 – , I – , Br – , Cl – ион : ОН – – более сильное основание, чем Н 2 О : и является худшей уходящей группой, чем вода: : Br – + R–OH R–Br + : OH – спирт реакция не идет
64. ГАЛОГЕНОПРОИЗВОДНЫЕ .. + H R – O – H .. .. + R – O – H + H 1. 2. : Br – + R–OH 2 R–Br + H 2 O замещение идет хорошо Протонные растворители – растворители типа воды НОН и спиртов R – OH ; эти растворители содержат водород, связанный с кислородом (или другим сильно электроотрицательным элементом) и вследствие этого довольно кислый. +
65. Протонные растворители – растворители типа воды НОН и спиртов R – OH ; эти растворители содержат водород, связанный с кислородом (или другим сильно электроотрицательным элементом) и вследствие этого довольно кислый. ПРИРОДА РАСТВОРИТЕЛЯ
66. ГАЛОГЕНОПРОИЗВОДНЫЕ Образуя водородные связи с анионами такие растворители понижают их основность, а следовательно и нуклеофильность. АПРОТОННЫЕ РАСТВОРИТЕЛИ: диметил-сульфоксид (ДМСО) CH 3 – S – CH 3 N , N -диметил- формамид (ДМФ) О CH 3 CH 3 H – C – N S О О сульфолан О
67. ГАЛОГЕНОПРОИЗВОДНЫЕ Апротонные растворители – полярные раствори-тели с высокой диэлектрической проницаемостью, но не способны к образованию водородных связей. Они составляют анионы относительно свободны-ми и сильно реакционноспособными (высоко нуклеофильными). Реакции отщепления: Реакции отщепления приводят к образованию алкенов. Эти реакции часто конкурируют с реакциями нуклеофильного замещения: (CH 3 ) 3 C–Cl (CH 3 ) 3 C + + : Cl – (CH 3 ) 3 C + CH 3 –C=CH 2 - H +
68. ГАЛОГЕНОПРОИЗВОДНЫЕ Реакциям отщепления способствует высокая t ˚ и основность среды. Конкуренция реакций замещения ( S N – реакций) и отщепления (Е – реакций) S N 2, Е2 S N 1, Е1 : Nu – С – С + H Х – С – С – : Nu H
69. ГАЛОГЕНОПРОИЗВОДНЫЕ Важнейшие представители Ненасыщенные галогенопроизводные могут вступать в реакции присоединения, обладая способностью легко полимеризовываться, образуя высокомолекулярные вещества: Примеры : поливинилхлорид винилхлорид 1. nCH 2 =CHCI [–CH 2 –CHCI –] n 2. nCF 2 =CF 2 [–CF 2 –CF 2 –] n тетрафторэтилен тефлон фторэтен поливинилфторид 3. nCH 2 =CHF [–CH 2 –CHF –] n
70. ГАЛОГЕНОПРОИЗВОДНЫЕ 4. nCH 2 =CF 2 [–CH 2 –CF 2 –] n 1,1-дифторэтан поливинилиденфторид 1,1,2-трифтор-2-хлорэтен политрифтор-хлорэтилен 5. nCF 2 = CFCI [– CF 2 – CFCI –] n Фреоны ( CF 2 CI 2 )– галогеналканы, фторсодержащие производные насыщенных углеводо-родов, используемые как хладагенты. Это бесцветные газы или жидкости, без характерного запаха, очень инертны, не горят в воздухе,взрывобезопасны.
14. Хлорпроизводные углеводородов представляют большую опасность для окружающей среды. Их применение во многих областях промышленности (нефтеперерабатывающей, авиационной, строитель-ной, электронной, в сельском и коммунальном хозяйстве) делает неизбежным их попадание в атмосферу. Хлорпроизводные предельных и непредельных углеводородов – летучие наркотики. Пары хлорпроизводных этана действуют сильнее, чем этилена и тем более метана. Для хлорпроизводных одного и того же углеводорода сила наркотического действия в водных растворах возрастает с увеличением числа атомов хлора. При высокой концентрации паров хлоруглеводородов могут наблюдаться значительные расстройства со стороны внутренних органов (печень, почки, поджелудочная железа, сердечная мышца). Особенно страдает печень при действии СС14, тетра- и пентахлорэтана; слабее – при отравлении хлороформом и 1,2-дихлорэтаном. Бромопроизводные предельных углеводородов – наркотики, обладающие большей токсичностью. По токсичности они превосходят хлорпроизводные, но уступают иодпроизводным (сказывается ослабление связи С-Hal). Даже при концентрациях, не вызывающих наркоз, бромпроизводные углеводородов вызывают серьезные изменения в печени, почках, сердечной мышце, а также со стороны центральной нервной системы. Ядовитыми являются также бромпроизводные непредельных углеводородов. Токсическое действие иодпроизводных предельных углеводо-родов напоминает действие бромпроизводных, но наркотическое свойство выражено слабее. В то же время резче проявляется токсичность для центральной нервной системы. Особое место занимает йодистый метил, который вызывает тяжелые отравления при длитель-ном воздействии (даже при небольших концентрациях). По сравнению с другими галогенопроизводными иодуглеводороды легче отщепляют атом галогена, что приводит к образованию короткоживущих свобод-ных радикалов. Это, скорее всего, обусловливает высокую токсичность иодпроизводных. Токсичность снижается при изменении длины и разветвленности углеродной цепи. Известно, что смешанные галогенопроизводные широко используют в качестве фреонов. Они менее токсичны, чем хлор- или бромпроизводные. Однако имеются указания на некоторую опасность воздействия на организм человека и животных со стороны этих веществ. Так, в производственных условиях известны случаи острого и хронического отравления. Например, при вдыхании фреона-12 (CF2C12) и фреона-114 (C2F4CI2) возникает аритмия сердца. Особенно опасны фреоны при повышенном выделении адреналина (физическая работа, волнение, стрессы). Фреон-22 вызывает головную боль, головокружение, боли в области сердца, утомляемость и так далее. В последние годы при широком использовании аэрозольных и противопожарных устройств в атмосферу попадает огромное количество различных фреонов. В земной атмосфере они могут вступать во взаимодействие с озоном, который защищает Землю от интенсивного ультрафиолетового излучения.
16. Спирты – это органические соединения, в молекулах которых содержатся одна или несколько гидроксильных групп, соединенных с углеводородным радикалом.
