
- •«Тверской государственный технический университет»
- •Введение
- •1 Теория кристаллического поля
- •Основные положения теории кристаллического поля
- •Параметр расщепления полем лигандов
- •1.3 Энергия стабилизации полем лигандов
- •Слабое и сильное поле лигандов
- •Магнитные изменения
- •2 Теория поля лигандов
- •3 Применение теории кристаллического поля и теории поля лигандов
- •Заключение
- •Список использованных источников
1.3 Энергия стабилизации полем лигандов
Поскольку
существуют три
-
и две
-орбитали,
то
расположены на
 ниже
средней энергии, а
-орбитали
лежат на
ниже
средней энергии, а
-орбитали
лежат на
 выше
средней энергии. По отношению к средней
энергии энергия
-
орбиталей составляет —0,4Δ0,
а
-орбиталей
+0,6Δо.
Таким образом, общая энергия электронной
конфигурации
выше
средней энергии. По отношению к средней
энергии энергия
-
орбиталей составляет —0,4Δ0,
а
-орбиталей
+0,6Δо.
Таким образом, общая энергия электронной
конфигурации
 относительно средней энергии орбиталей,
называемая энергией стабилизации полем
лигандов (ЭСПЛ), составляет:
относительно средней энергии орбиталей,
называемая энергией стабилизации полем
лигандов (ЭСПЛ), составляет:
ЭСПЛ = (-0,4x+ 0,6у) • Δ0
Величины ЭСПЛ для различных электронных конфигураций приведены в таблице:
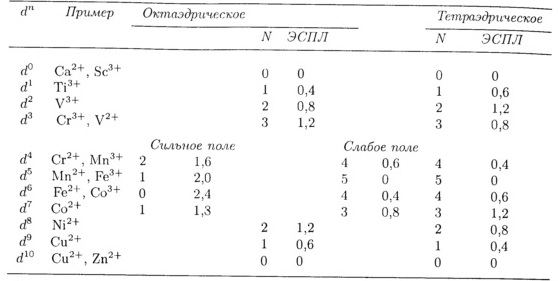
Таблица 1 – Энергия стабилизации полем лигандов
ЭСПЛ
следует рассматривать как фактор,
вносящий лишь небольшую поправку в
общую энергию взаимодействия между
ионом металла и лигандами. Взаимодействия
металл-лиганд становятся сильнее при
переходе слева направо по периоду
благодаря уменьшению радиуса ионов
 в этом ряду[2].
в этом ряду[2].
Слабое и сильное поле лигандов
Для того чтобы сделать заключение об основной электронной конфигурации комплексов d-металлов, нужно использовать диаграмму энергетических уровней d-орбиталей в качестве базиса для применения принципа заполнения орбиталей. Ищется наинизшая по энергии конфигурация, подчиняющаяся принципу Паули (не более двух электронов на орбитали) и (если имеется более чем одна вырожденная орбиталь) требованию, чтобы электроны в первую очередь занимали свободные орбитали, при этом их спины параллельны друг другу. Далее рассматриваются комплексы, образованные 3d-элементами.
Первые
три Зd
- электрона
 -
комплекса занимают отдельные несвязывающие
-орбитали,
при этом их спины остаются параллельны
друг другу. Например, ионы
-
комплекса занимают отдельные несвязывающие
-орбитали,
при этом их спины остаются параллельны
друг другу. Например, ионы
 и
и
 имеют электронные конфигурации
соответственно 3d2
и 3d3.
3d-электроны занимают низшие по энергии
-орбитали,
можно определить величины ЭСПЛ для
комплексов
имеют электронные конфигурации
соответственно 3d2
и 3d3.
3d-электроны занимают низшие по энергии
-орбитали,
можно определить величины ЭСПЛ для
комплексов


Рисунок 4 - электронные конфигурации 3d2 и 3d3
Следующий
электрон, необходимый для
 -иона
-иона
 ,
может занять одну из
-орбиталей
и спариться с электроном, который уже
находится на этой орбитали. Если это
происходит, электрон испытывает сильное
электростатическое отталкивание,
которое называют энергией спаривания
Р.
,
может занять одну из
-орбиталей
и спариться с электроном, который уже
находится на этой орбитали. Если это
происходит, электрон испытывает сильное
электростатическое отталкивание,
которое называют энергией спаривания
Р.
В
случае Δ0
< Р:
наинизшая энергия достигается, если
занята высшая по энергии орбиталь,
т. е. электронная конфигурация будет
 ,
это слабое
поле.
В
случае Δ0
> Р:
наинизшая
энергия достигается, если занята
только низшая по энергии орбиталь,
несмотря на затраты на спаривание
электронов, и возникает электронная
конфигурация
,
это слабое
поле.
В
случае Δ0
> Р:
наинизшая
энергия достигается, если занята
только низшая по энергии орбиталь,
несмотря на затраты на спаривание
электронов, и возникает электронная
конфигурация
 ,
это сильное поле.
,
это сильное поле.
Если существует альтернатива в выборе электронной конфигурации, то частицы с меньшим числом параллельных спинов электронов называют низкоспиновыми комплексами, а частицы с большим числом параллельных спинов электронов называют высокоспиновыми комплексами. Зd4-кoмплeкc будет низкоспиновым, если кристаллическое поле сильное, и высокоспиновым, если поле слабое.
Сила кристаллического поля (характеризуемая величиной Δ0) и энергия спаривания Р зависят от природы как металла, так и лиганда[2].
Магнитные изменения
Экспериментально низко- и высокоспиновые комплексы различают по их магнитным свойствам. Комплексы относят к диамагнитным, если они выталкиваются из магнитного поля, и к парамагнитным, если они втягиваются в магнитное поле. Степень парамагнетизма комплексов, как правило, выражают с помощью величины их магнитного дипольного момента: чем больше магнитный дипольный момент комплекса, тем больше парамагнетизм образца[2].
