
- •7.Энергия ионизации и сродство к электрону
- •24. Сильные и слабые электролиты
- •26. Равновесие в гетерогенных системах
- •31. Направление окислительно-восстановительных реакций
- •Либо проводят окислительно-восстановительную реакцию:
- •2. Взаимодействие с водородом
- •3. Взаимодействие с водой
- •58. Общая характеристика семейства железа
58. Общая характеристика семейства железа
Семейство железа входит в состав побочной подгруппы восьмой группы и является в ней первой триадой, включающей в себя железо, кобальт и никель. Эти элементы имеют два электрона на наружном слое атома, все они являются металлами. По свойствам все три элемента похожи между собой. Для них характерна степень окисления 2, 3, 4. Реже проявляются более высокие степени окисления. Ни один элемент из семейства железа не проявляет максимальной степени окисления +8. Все металлы триады образуют разнообразные соединения, проявляя степени окисления +2 и +3. Проявление высокой степени окисления и амфотерных свойств характерно для железа.
Температуры плавления элементов триады железа высокие, тем не менее, ниже, чем у элементов, находящихся в серединах серий переходных металлов.
Железо – первый элемент в переходных рядах, имеющий спаренный электрон на внутренней d-орбитали. Спаренные электроны с такой орбитали труднее участвуют в образовании химической связи, чем неспаренные. У триады железа существуют особенности орбитального строения, проявляющиеся в виде магнитных и ферромагнитных свойств. В результате ориентированности атомов металлы образуют постоянные магниты. Все металлы семейства железа проявляют электроположительное поведение. Инертны в среде окислителя, даже кислорода, так как образуют оксидные пленки.
Химические свойства железа:
1) взаимодействует с кислородом при высоких температурах;
2) оксиды в низшей степени окисления MO;
3) при взаимодействии с галогенами образует галогениды, дигалогениды;
4) образует комплексные соединения;
5) образует карбонилы – соединения, в которых переходный металл образует связь с ионом металла или водорода и координированными карбониловыми группами(пентакарбонил кобальта [Co(CO)5]);
6) взаимодействуют с серой и сероводородом при нагревании, образуя сульфиды.
Железо – второй (после алюминия) по распространенности металл, встречается в виде различных руд, пригодных для переработки. Из них получают почти чистый Fe3O4, который вместе с известняком и коксом используется для выплавки чугуна в доменной печи.
Кобальт выделяют из руд, содержащих много мышьяка и некоторой доли серебра, достаточной для промышленной переработки.
Никель – в руде много примесей: сульфиды никеля, меди и железа. Половина получаемого никеля расходуется в производстве стали для повышения ее коррозионной стойкости и твердости. Он используется также для создания прочных покрытий на стальных изделиях.
58.
ПОДГРУППА IVB. СЕМЕЙСТВО ТИТАНА ТИТАН, ЦИРКОНИЙ, ГАФНИЙ К переходным металлам относятся также элементы семейства титана Ti, Zr и Hf, отличающиеся удивительным сходством свойств. Последние два элемента (Zr и Hf) особенно близки по свойствам. Действительно, Hf был открыт благодаря рентгенографическому изучению цирконических материалов. Hf был первым элементом, открытым методом рентгенографии, и открыт он был спустя 140 лет после открытия циркония. Поэтому все значения атомной массы циркония, определенные до 1923, оказались неточны, так как Zr фактически всегда содержит некоторое количество гафния. Близкие к ковалентным атомные радиусы Zr и Hf, а также сходная внешняя электронная конфигурация d2s2 делают понятным большое сходство химических и многих физических свойств. Появление у гафния 32 протонов и около 50 нейтронов (в зависимости от изотопного состава) в том же объеме, что и у Zr, приводит к значительно большей плотности Hf по сравнению с его предшественником (см. табл. 11). Все три элемента подгруппы относятся к истинным металлам, проявляют хорошую электропроводность, обладают положительным электродным потенциалом, образуют типичные соли. Металличность в подгруппе несколько возрастает от титана к гафнию. Все эти металлы имеют стабильную степень окисления IV, тем не менее химическая связь в их галогенидах и некоторых других солях типично ковалентная. Они могут проявлять также степень окисления II и III, но из этих состояний легко окисляются до степени окисления IV. Титан. Титан девятый по распространенности элемент земной коры. Его руды очень устойчивы к обычным реагентам. Развитие металлургии титана объясняется обнаружением у него полезных свойств способностью образовывать коррозионностойкие и термостойкие сплавы. Обычные восстановители, такие, как кокс и уголь, непригодны для выделения титана из его оксида TiO2, так как при этом образуются очень тугоплавкие и твердые карбиды титана типа TiC. Процесс получения титана заключается в пропускании газообразного Cl2 над TiO2 или FeTiO3 в присутствии углерода. Образующийся при этом летучий тетрахлорид титана TiCl4 выделяется из системы, а затем его конденсируют в жидкость (т. кип. 136° С) и очищают с помощью перегонки. Восстановление тетрахлорида до металла проводят магнием при 750900° С в инертной среде благородного газа, например аргона. Эффективным восстановителем является также натрий. Образующийся губчатый металлический титан необходимо спекать или нагревать до высоких температур для получения пластичного массивного слитка. Чистый пластичный металл получается и при восстановлении тетраиодида в водородной среде на нагретой вольфрамовой нити. Для производства титановых сталей используют титан, полученный восстановлением FeTiO3 углеродом. Обычно металл получают в виде ферротитанового сплава, который добавляют в расплав стали без дополнительной очистки. Добавки титана в сталь увеличивают ее прочность и ударную стойкость. Небольшая плотность титана, коррозионная стойкость и низкий коэффициент теплового расширения позволяют использовать эти сплавы в авиационной и ракетной технике. Проблемой для широкого применения является быстрое уменьшение прочности титановой стали при нагревании. Кроме того, при нагревании на поверхности сплава образуются оксиды и нитриды, что увеличивает ломкость. Карбиды, нитриды и бориды титана очень тугоплавки и тверды, поэтому их применяют в технологии режущего и сверлильного инструмента. См. также МЕТАЛЛЫ ЧЕРНЫЕ; СПЛАВЫ; АВИАЦИОННО-КОСМИЧЕСКИЕ КОНСТРУКЦИИ. Цирконий и гафний. Руды циркония и гафния представляют собой силикаты и оксиды. Методы извлечения и выделения циркония и гафния довольно близки к методам, применяемым в металлургии титана. Чистый цирконий применяется в атомной энергетике, так как имеет очень низкое сечение захвата и поглощения нейтронов, а также высокую термо- и коррозионную стойкость. Добавки циркония улучшают свойства хромовых сталей. Применение гафния в промышленности осложняется трудностью его отделения от циркония и малой распространенностью в природе. Разделение гафния и циркония основано на небольшом различии в растворимости фторокомплексов ZrF62и HfF62. Разделение металлов возможно также методами ионного обмена и экстракции комплексных соединений. Химические свойства. Существует некоторое различие в химических свойствах титана, с одной стороны, и циркония и гафния, с другой. Все металлы IVB подгруппы реагируют при нагревании с кислородом, образуя MO2. Диоксид титана TiO2 существует в природе в виде минерала рутила темнокоричневого вещества с примесями. TiO2 в промышленности получают по реакции TiCl4 со щелочью с последующим прокаливанием для удаления воды; получаемый таким способом TiO2 представляет собой белое инертное вещество, широко применяемое как пигмент; оно не ядовито и благодаря прочной адгезии используется в промышленности красок. При гидролизе TiCl4 образуется не истинный гидроксид Ti(OH)4, а гидратированный оксид, который существует в двух формах, a и b. При испарении или распылении TiCl4 во влажной среде получают дымовые завесы. При высокой температуре TiO2 переходит в оксид титана(III) Ti2O3. Монооксид TiO получается при прокаливании смеси Ti + TiO2. При сплавлении TiIVO2 с основаниями, например, NaOH или Na2CO3, получается титанат натрия Na2TiIVO3, что свидетельствует об амфотерности TiO2. Титан проявляет несколько более слабые металлические свойства, чем цирконий, так как TiCl4 почти не подвергается гидролизу, образуя TiOCl2. Более тяжелые металлы подгруппы легко образуют ионы MO22+. Zr и Hf тоже образуют диоксиды ZrO2 и HfO2, а также полуторные оксиды Zr2O3 и Hf2O3 и монооксиды ZrO и HfO. Однако только образование диоксидов является общим для всей подгруппы. Гидроксиды Zr(OH)4 и Hf(OH)4, очевидно, не существуют, но при взаимодействии ионов этих металлов со щелочами образуются гидратированные оксиды. Образование гидроксидов с низшими степенями окисления металлов не установлено. Активность металлов по отношению к кислороду, кислотам и основаниям сильно зависит от чистоты металла. При действии сильных оснований на диоксиды образуются цирконаты MZrO3 и гафнаты MHfO3. Галогениды. Большинство галогенидов всех трех элементов известно для всех степеней окисления металлов. Например, тетрахлорид титана TiCl4 получается в виде бесцветного газа при обработке TiO2 хлором при повышенных температурах в присутствии углерода. При конденсации образуется жидкость. TiCl4 похож на SiCl4, но имеет более высокую температуру кипения, что объясняется различием в строении молекул (у SiCl4 тетраэдрическая, а у TiCl4 искаженная структура). При восстановлении TiCl4 металлическим натрием получается TiCl2. Трихлорид титана TiCl3 образуется при восстановлении TiCl4 водородом. Хлориды, бромиды и иодиды всех трех металлов в низших степенях окисления интенсивно окрашены и неустойчивы. Соли Ti(III) находят применение в аналитической химии как восстановители. Тетрагалогениды легко принимают два галогенид-иона, образуя комплексные ионы: TiCl4 + 2Cl <=> [[TiCl6]]2 Тетрафторид титана образуется при обработке TiCl4 парами фтороводорода HF: TiCl4 + 4HF <=> TiF4 + 4HCl Среди других галогенидов известны TiI2 , TiI3, TiI4, ZrI4. Сульфиды. При обработке TiCl4 сероводородом на холоду образуются TiS и сера, а при нагревании TiS2. Последний восстанавливается водородом до Ti2S3, а при действии HNO3 на TiS2 образуются соединение Ti(IV) и элементная сера. Цирконий и гафний также образуют моносульфиды и дисульфиды. Комплексообразование. Увеличение металлического характера тяжелых членов семейства проявляется в образовании цирконил- и гафнил-ионов при гидролизе солей М(IV) в воде. Такое химическое сродство маленьких по размеру с большим положительным зарядом ионов способствует образованию многочисленных комплексных соединений с органическими оксосоединениями. Особенно устойчивы дикетонатные комплексы Zr(IV) и Hf(IV). Сильное комплексообразующее действие проявляется в образовании галогенидных комплексных ионов типа [[HfF7]]3с необычно большим и редким координационным числом 7.58.
63..В периоде с ростом Z восстановительные свойства металлов уменьшаются, достигая минимума у элементов IВ группы. Тяжелые металлы VIIIВ и IВ групп за свою инертность названы благородными.
Окислительно-восстановительные тенденции соединений d-элементов определяются изменением устойчивости высших и низших степеней окисления в зависимости от положения их в периодической системе. Соединения с максимальной степенью окисления элемента проявляют исключительно окислительные свойства, а с низшей – восстановительные. Mn(OH)2 легко окисляется на воздухе Mn(OH)2 + 1/2O2 = MnO2 + H2O. Соединения Mn(IV) легко восстанавливаются до Mn (II): MnO2 + 4HCl = MnCl2 + Cl2+ 2H2O, но сильными окислителями окисляется до Mn (VII). Перманганат-ион MnO4– может быть только окислителем.
Поскольку для d-элементов в пределах подгруппы устойчивость высших степеней окисления сверху вниз растет, то окислительные свойства соединений высшей степени окисления резко падают. Так, соединения хрома (VI) (CrO3, K2CrO4, K2Cr2O7) и марганца(VII) (Mn2O7, KMnO4) – сильные окислители, а WO3, Re2O7 и соли соответствующих им кислот (H2WO4, HReO4) восстанавливаются с трудом.
На кислотно-основные свойства гидроксидов d-элементов влияют те же факторы (величина ионного радиуса и заряд иона), что и на гидроксиды p-элементов.
Гидроксиды низших степеней окисления d-элементов обычно проявляют основные свойства, а отвечающие высшим степеням окисления – кислотные. В промежуточных степенях окисления гидроксиды амфотерны. Особенно отчетливо изменение кислотно-основных свойств гидроксидов при изменении степени окисления проявляется в соединенинях марганца. В ряду Mn(OH)2 – Mn(OH)3 – Mn(OH)4 – H2MnO4 – HMnO4 свойства гидроксидов меняются от слабого основания Mn(OH)2 через амфотерные Mn(OH)3и Mn(OH)4 к сильным кислотам H2MnO4 и HMnO4.
В пределах одной подгруппы гидроксиды d-элементов одинаковой степени окисления характеризуются увеличением основных свойств при движении сверху вниз. Например, в IIIВ группе Sc(OH)3 – слабое, а La(OH)3 – сильное основание. Элементы IVВ группы Ti, Zn, Hf образуют амфотерные гидроксиды Э(OH)4, но кислотные свойства их ослабевают при переходе от Ti к Hf.
64. Соединения марганца (VI) малоустойчивы, однако наиболее известное соединение — манганат калия K2MnО4 — устойчив в щелочной среде. Он образуется при восстановлении перманганата калия в щелочной среде, например:
![]()
Вообще для Mn6+ характерны следующие продукты окислительно-восстановительных реакций:

Например: ![]()
Перманганат калия. Высшую степень окисления 7+ марганец имеет в кислотном оксиде Мn2О7 и перманганате калия КмnO4. Последнее вещество — кристаллы фиолетового цвета, хорошо растворимые в воде.
Перманганат калия — сильнейший окислитель. В кислой среде он восстанавливается до ионов Мn2+:
![]()
в щелочной среде — до К2МnO4 (см. выше), а в нейтральной среде — до MnO2:
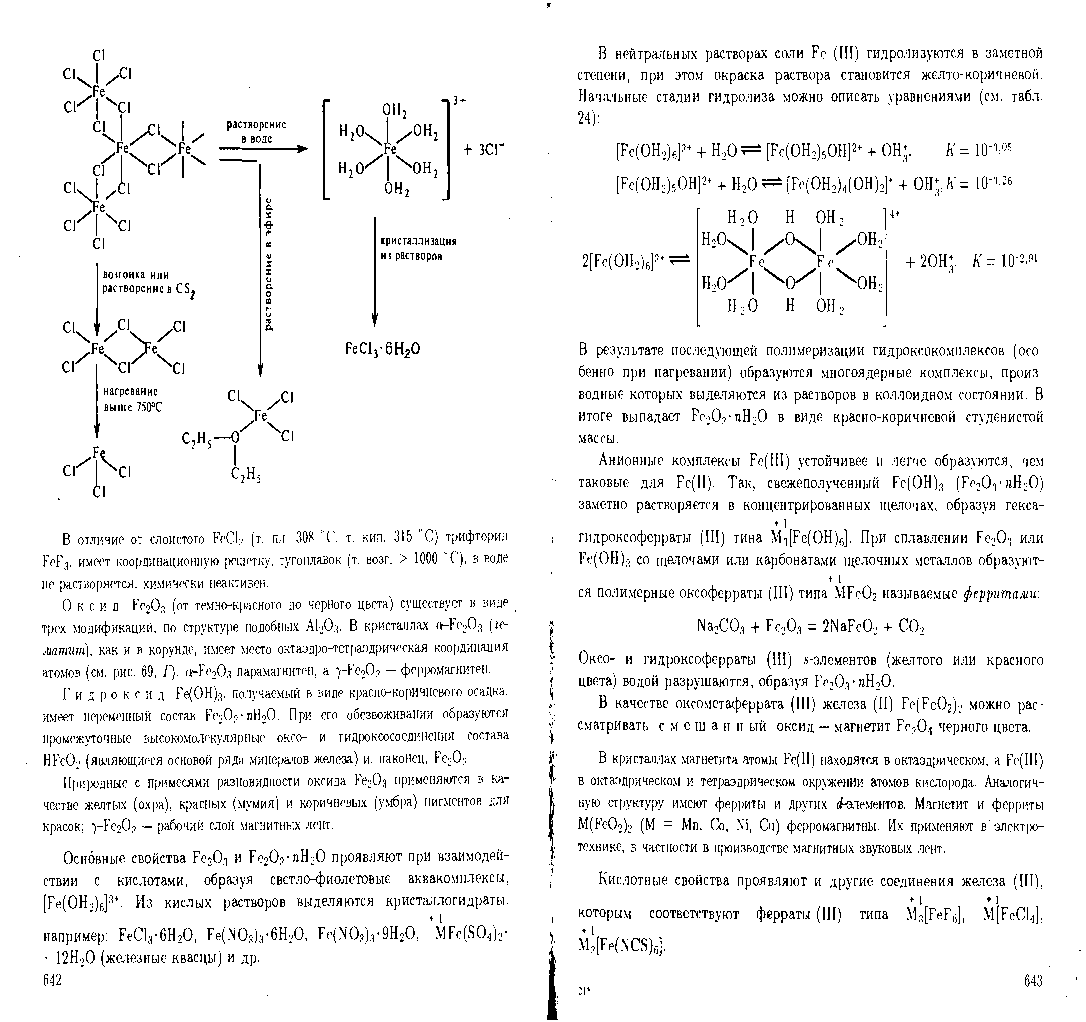
65. Железо образует 2 вида оксидов и гидроксидов: FeO – оксид железа (II) – черный, Fe(OH)3-гидроксид железа (II) – белый, проявляют основные свойства: Fe2O3-оксид железа (III) – красно-бурый, Fe(OH)3-гидроксид железа (III)- бурый, проявляет амфотерные свойства. Fe2+,Fe3+. Растворимые соли ионов Fe2+,Fe3+ реагируют при комнатной температуре с растворами щелочей:
FeSO4
+ NaOH
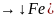
FeCl3 +3 NaOH
Оксид и гидроксид желез (II) вступают в реакцию с кислотами
FeO +2HCl = FeCl2 + H2O
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
Оксид железа (III) и гидроксид железа (III) амфотерны, вступают в реакцию:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + Na2O= 2NaFeO2
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3NaOH = Na3[Fe(OH)6]
Гидроксиды железа (II) и (III) при нагревании разлагаются:
Fe(OH)2=FeO + H2O
2Fe(OH)3=Fe2O3+3H2O
Белый осадок гидроксида железа (II) на воздухе меняет окраску:сначала зеленоватая, затем бурая. Катионы железа (II) легко окисляются кислородом воздуха до катиона железа (III).
4Fe(OH)2+2H2O+O2=4Fe(OH)3
65. Железо образует 2 вида оксидов и гидроксидов: FeO – оксид железа (II) – черный, Fe(OH)3-гидроксид железа (II) – белый, проявляют основные свойства: Fe2O3-оксид железа (III) – красно-бурый, Fe(OH)3-гидроксид железа (III)- бурый, проявляет амфотерные свойства. Fe2+,Fe3+. Растворимые соли ионов Fe2+,Fe3+ реагируют при комнатной температуре с растворами щелочей:
FeSO4 + NaOH
FeCl3 +3 NaOH
Оксид и гидроксид желез (II) вступают в реакцию с кислотами
FeO +2HCl = FeCl2 + H2O
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
Оксид железа (III) и гидроксид железа (III) амфотерны, вступают в реакцию:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + Na2O= 2NaFeO2
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3NaOH = Na3[Fe(OH)6]
Гидроксиды железа (II) и (III) при нагревании разлагаются:
Fe(OH)2=FeO + H2O
2Fe(OH)3=Fe2O3+3H2O
Белый осадок гидроксида железа (II) на воздухе меняет окраску:сначала зеленоватая, затем бурая. Катионы железа (II) легко окисляются кислородом воздуха до катиона железа (III).
4 Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe(OH)2+2H2O+O2=4Fe(OH)3







67.
68.
d-Элементы чаще, чем элементы главных подгрупп, образуют соединения переменного состава (оксиды, гидриды, карбиды, силициды, нитриды, бориды). Кроме того, они образуют сплавы между собой и с другими металлами, а также интерметаллические соединения.
Для d-элементов характерен большой набор валентных состояний (табл. 8.10) и, как следствие этого, изменение кислотно-основных и окислительно-восстановительных свойств в широких пределах.
Соединения, в которых d-элементы находятся в низшей степени окисления, образуют кристаллы ионного типа, в химических реакциях проявляют основные свойства и являются, как правило, восстановителями.
Окислительно-восстановительные тенденции соединений d-элементов определяются изменением устойчивости высших и низших степеней окисления в зависимости от положения их в периодической системе. Соединения с максимальной степенью окисления элемента проявляют исключительно окислительные свойства, а с низшей – восстановительные.
Со(III) является сильным окислителем.
[Co(OH2)6](+3)+e(-)=[Co(OH2)6](+2)
Окислительные свойства хлора и кислорода – окисление Co(II) в Co(III): 2CoSO4+Cl2+3NiCO3+3H2O=2Co(OH)3+2NiSO4+NiCl2+3CO2 Co2+-1e=Co3+ Cl20+2е=2Cl- 6CoCl2+1,5O2=4CoCl3+Co2O3 Co2+-1e=Co3+ O20+4е=2O2-
69.
При нагревании на воздухе выше 200 °С железо взаимодействует с кислородом, образуя оксиды нестехиометрического состава FexO, мелкодисперсное железо сгорает с образованием смешанного оксида железа (II, III):
3Fe + 2O2 = Fe3O4.
Кобальт и никель реагируют с кислородом при более высоких температурах, образуя в основном оксиды двухвалентных элементов, имеющие переменный состав в зависимости от условий получения:
2Co + O2 = 2CoO,
2Ni + O2 = 2NiO.
С галогенами металлы реагируют, образуя галогениды :
2Fe + 3Cl2 = 2FeCl3,
Co + Br2 = CoBr2,
Ni + Cl2 = NiCl2.
Металлы довольно устойчивы к действию фтора, никель не разрушается фтором даже при температуре красного каления.
При взаимодействии с азотом при невысокой температуре железо, кобальт и никель образуют нитриды различного состава, например:
4Fe + N2 = 2Fe2N,
2Co + N2 = 2CoN,
3Ni + N2 = Ni3N2.
Взаимодействие с серой экзотермично и начинается при слабом нагревании, в результате образуются нестехиометрические соединения, которые имеют состав, близкий к ЭS:
Э + S = ЭS.
С водородом металлы триады железа не образуют стехиометрических соединений, но они поглощают водород в значительных количествах.
С углеродом, бором, кремнием, фосфором также при нагревании образуют соединения нестехиометрического состава, например:
3Co + C = Co3C,
2Ni + B = Ni2B,
Co + Si = CoSi,
3Fe + P = Fe3P.
70. Fe2O3 + 6HCl = 2FeCl3 + 3H2O здесь основные свойства
Fe2O3 + 2NaOH = 2NaFeO2 + H2O - а здесь - кислотные свойства
Соединения со степенью окисления железа +3 проявляют окислительные свойства, так как под действием восстановителей Fe+3 превращается в Fe+2:
Fe+3 + 1e = Fe+2.
2Fe+3Cl3 + 2KI = 2Fe+2Cl2 + 2KCl + I20
71.
Ti(3)
Ti2(+3)O3+H2SO4(конц)=SO2+H2O+Ti2(SO4)3
Соединения Тi(4) обладает основними свойствами.
Ti(+4)O2+H2SO4=TiOSO4+H2O
CoCl2 + 7KNO2 + 2CH3COOH = K3[Co(NO2)6] ↓ + NO + 2CH3COOK + 2KCl
Степень окисления (III) является неустойчивой для кобальта, поэтому гидроксид Co(III)
проявляет окислительные свойства, даже под воздействием такого слабого восстановителя
2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
Соединения никеля(III) проявляют
сильные окислительные свойства:
4 Ni(OH)3↓ + 4 Н2SО4 = 4 NiSО4 + О2 + 10 Н2О
72.Степени окисления закономерно изменяются при переходе от одного элемента к другомув периодической системе. Высшая степень окисления элементов в группе обычно равна номеру группы, таким образом, в периодах высшая степень окисления растет. В главных подгруппах при переходе от элементов сверху вниз обычно становятся более устойчивыми низкие степени окисления, в побочных подгруппах, наоборот, устойчивы более высокие.
Fe . 2,3,(4),6 Co O2,3,(4) Ni 2,(3),(4) степ. Окислен.
Химические свойства Fe, Co, Ni
1. Пассивируются концентрированными H 2 SO 4 , HNO 3 и царской водкой
2. Растворяются в кислотах
Co + 2HCl = CoCl 2+ H 2
10Fe + 36HNO 3(разб) = 10Fe(NO 3 ) 3+ 3N 2+ 18H 2 O
5Ni + 12HNO 3(разб) = 5Ni(NO 3 ) 2+ N 2+ 6H 2 O
3. Не растворяются в щелочах
4. Реагируют с кислородом при нагревании
мелкодисперсное чистое железо пирофорно!
4Fe + 3O 2= 2Fe 2 O 3Fe3+3Co + O 2= Co 3 O 4
Co3+, Co2+2Ni + O 2= 2NiO Ni2+
5. Железо ржавеет
4Fe + 3O 2+ 2H 2 O = 4FeO(OH)
6. Реагируют с галогенами
FeX 3(но FeI 2 ), CoX 2(но CoF 3 ), NiX 2
7. Реагируют с неметаллами при нагревании
Fe + S 2= FeS 2
3Ni + 2S = Ni 3 S 2
Fe + P = FeP 4
Co + P = CoP 3
Fe + C = Fe 3 C (цементит)
73. Mn(7) обладает кислотными свойствами.
Mn2O7+H2O=HMnO4
MnO7=MnO5+O2
Окислительно-восстановительные свойства.
KMn(+7)O4+H2SO4+K2SO3(+4)=Mn(+2)SO4+H2SO(+6)+H2O
Re(7)
Tc(7)
74.
Mn(4)
Восстановительные свойства.
Mn(+4)O2+O2(0)+NaOH=Na2Mn(+6)O4+H2O(-2)
Окислительные свойства.
Mn(+4)O2(-2)+Н2SO4=O2(0)+Mn(+7)SO4(-2)+H2O
Mo(4)
W(4)
75. Ti(4)
Соединения Тi обладает основними свойствами.
Ti(+4)O2+H2SO4=TiOSO4+H2O
Окислительно-восстановительные свойства
Zr(4)
Hf(4)
76.Окислительно-восстановительные свойства проявляются в щелочной среде. Соединения Cr(6)
Cr(OH)+KOH+Br2=H2CrO4+KBr+H2O
Соединения Cr6 обладает кислотными свойствами.
Cr(+6)O3+H2O=H2CrO4
CrO3+KOH=K2[CrO4]2-
Mn(7) обладает кислотными свойствами.
Mn2O7+H2O=HMnO4
MnO7=MnO5+O2
Окислительно-восстановительные свойства.
KMn(+7)O4+H2SO4+K2SO3(+4)=Mn(+2)SO4+H2SO(+6)+H2O
Fe(6)
Окислительно-восстановительные свойства
![]()
Fe(+4)—Fe(+6)
