
- •7.Энергия ионизации и сродство к электрону
- •24. Сильные и слабые электролиты
- •26. Равновесие в гетерогенных системах
- •31. Направление окислительно-восстановительных реакций
- •Либо проводят окислительно-восстановительную реакцию:
- •2. Взаимодействие с водородом
- •3. Взаимодействие с водой
- •58. Общая характеристика семейства железа
26. Равновесие в гетерогенных системах
Большинство веществ могут существовать в одном из трех агрегатных состояний: газообразном (парообразном), жидком и твердом. В определенных условиях эти фазы способны переходить друг в друга, то есть всякую жидкость путем испарения можно перевести в газ, а охлаждением – в твердое состояние
Равновесия между различными фазами одной системы называют фазовыми, а описывают эти фазовые равновесия посредством фазовых диаграмм или диаграмм состояния. Фазовая диаграмма позволяет установить условия равновесия между числом фаз, числом компонентов и числом степеней свободы (вариантностью) системы.
Фаза (Ф) – гомогенная (однородная по химическому составу и термодинамическим свойствам) часть системы, отделенная от других частей поверхностью раздела. Так, два нерастворимых друг в друге твердых вещества, как и две несмешивающиеся жидкости, образуют две фазы.
Компоненты (К)– химически индивидуальные вещества, наименьшее число которых достаточно для образования фаз системы.
Растворимость вещества.
1)эндотермический(поглащение)-связан с разрывам химического вещества при взаимодействии с молекулами вещества и образованием иона.
2)экзотермический-связан с гидролизом и образованием гидрата аммония.
При растворимости малорастворимого вещества диссацирует и константо равновесия этого процесса будет=KnAm=nKm+(p)+mAn-(p)
K=[Km+]n *[An-]m\1=ПР
Чем меньше растворимости, тем меньше константа в системе, осадок в растворе и тем меньшей степени происходит растворение.
27. Смещение ионных равновесий.
Равновесие в растворах электролитов сохраняется неизменным, пока определяющие его условия не изменяются. Изменение условий влечёт за собой нарушение равновесия.
Таким образом, введение в раствор слабого электролита одноимённых ионов уменьшает степень диссоциации этого электролита, и наоборот, уменьшение концентрации одного из ионов вызывает диссоциацию нового количества его молекул.
Реакции в растворах электролитов протекают в сторону удаления из раствора тех или иных ионов в следствии образования слабо диссоциирующих веществ или веществ, выделяющихся из раствора в виде осадка или газа.
УСЛОВИЯ ОДНОСТОРОННЕГО ПРОТЕКАНИЯ РЕАКЦИЙ
Различают реакции с изменением и без изменения степеней окисления элементов. Понятно, что такое подразделение условно и основано на формальном признаке — возможности количественного определения условной величины — степени (состояния) окисления элемента. Неизменность степени окисления элементов при химических превращениях вовсе не означает, что не происходит перестройки электронных структур взаимодействующих атомов, ионов и молекул. Конечно, и в этом случае протекание реакции обязательно связано с большим или меньшим изменением характера межатомных, межионных и межмолекулярных связей, а следовательно, и эффективных зарядов атомов.
Реакции без изменения состояния окисления элементов чаще всего протекают в газовых и жидких растворах с участием ионов. Как известно, ионные реакции обратимы, и теоретически каждой системе ионов при данных условиях отвечает определенное состояние равновесия. Смещение химического равновесия (иногда практически нацело) происходит при уменьшении концентрации каких-либо ионов за счет образования относительно мало ионизирующихся молекул или комплексных ионов, малорастворимых или летучих соединений (правило Бертолле). Так, при нейтрализации ионная реакция идет в сторону образования мало ионизирующихся молекул растворителя, например в водном растворе:
КОН(р) + HN03(p) = KN03(p) + Н20(ж), AG°2gs = -80 кДж
Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов.
Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена.
В соответствии с правилом Бертолле: реакции обмена протекают только тогда, когда образуется малорастворимое соединение (осадок), легколетучее вещество (газ), или малодиссоциирующее соединение (очень слабый электролит, в том числе и вода). В таких случаях реакции будут практически не обратимы.
Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O
2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + CO2↑ + H2O
CO32- + 2H+ → CO2↑ + H2O
28. Гидролиз по катиону,- соль образована слабым основанием(все основания,кроме восьми щелочей LiOH,NaOH,KOH,RbOH,CsOH,Ca(OH)2,Sr(OH)2,Ba(OH)2).Вэтом случае среда кислая рН раствора меньше 7. Гидролиз по аниону,- соль образована слабой кислотой(все кислоты,кроме HCl,HBr, HI,H2SO4,HNO3,HClO4). Реакция среды щелочная,рН раствора больше 7. Гидролиз по катиону и аниону,- соль образована слабой кислотой и слабым основанием.Чтобы определить реакцию среды надо посмотреть на значение константы диссоциации кислоты и основания. Полный гидролиз Al2S3 + 6H2O = 2Al(OH)3 + 3H2S.
Men+ + H-OH MeOH(n-1)+ + H+ Гидролиз по катиону приводит к образованию гидроксокатионов и ионов водорода (среда раствора кислая).
Ann– + H-OH HAn(n-1)– + OH–
Гидролиз по аниону приводит к образованию гидроанионов и гидроксид-ионов (среда раствора щелочная).
констант равновесия (констант гидролиза) имеют вид:
 и
и 
На
конкретных примерах покажите сущность
реакций гидролиза ионных соед по катиону
и по аниону; какая среда(кислая или
щелочная)образуется при их гидролизе?Приведите
константы гидролиза по аниону и катиону
и рассмотрите их связь с константами
ионизации кислоты и основания.
Под
гидролизом понимают реакции обменного
разложения обменного разложения между
водой и соответствующим элементом.
Гидролиз обычно протекает без изменения
степени окисления элементов. Сущность
гидролиза состоит в том, что катион соли
(слабое основание) либо её анион (слабая
кислота) связывают соответственно ионы
OH
или H+ с образованием слабого электролита.
При гидролизе ионных соединений
возможны 4 случая:1) растворы солей
образованы катионами сильных оснований,
анионами сильной кислоты, характер
среды нейтральный.
NaCl↔Na⁺+Cl⁻
Na⁺+HOH≠
Cl⁻+HOH≠
2) растворы солей образованы катионами
сильного основания и анионами слабой
кислоты, подвергаются гидролизу по
аниону. Характер среды
щелочной.
Na₂CO₃↔2Na⁺+CO₃²⁻
Na⁺+HOH≠
(1)
CO₃²⁻+HOH=(HCO)₃⁻
+OH⁻
гидролизу подвергается лишь
часть соли и в растворе устанавливается
равновесие между солью и образующимся
основанием, тогда константа равновесия
для уравнения (1)( Кравн·[H2O]=
Кгидролиза.)
К=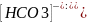 Учитывая
что концентрация ионов равна [OH⁻]=
Учитывая
что концентрация ионов равна [OH⁻]=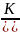 ,подставим уравнение это равнение в
уравнение для Кравн, получим уравнение
К(гидрол) по аниону.
в разбавленных
растворах концентрация воды величина
постоянная, тогда К(гидролиза)=[HOH].
константа по аниону связана с константой
ионизации кислоты.Чем слабее кислота,
тем в большей степени подвергается
гидролизу её соли.
3) растворы
солей образованы катионами слабого
основания и анионами сильной
кислоты,подвергаются гидролизу по
катиону, характер среды
кислый.
CuCl₂↔Cu²⁺+2Cl⁻
Cl⁻+HOH≠
(2)
Cu²⁺ + HOH↔ (CuOH)⁺ +H⁺
CuCl+HOH↔CuOH
запишем
Кравн для уравнения (2)
Кр=
,подставим уравнение это равнение в
уравнение для Кравн, получим уравнение
К(гидрол) по аниону.
в разбавленных
растворах концентрация воды величина
постоянная, тогда К(гидролиза)=[HOH].
константа по аниону связана с константой
ионизации кислоты.Чем слабее кислота,
тем в большей степени подвергается
гидролизу её соли.
3) растворы
солей образованы катионами слабого
основания и анионами сильной
кислоты,подвергаются гидролизу по
катиону, характер среды
кислый.
CuCl₂↔Cu²⁺+2Cl⁻
Cl⁻+HOH≠
(2)
Cu²⁺ + HOH↔ (CuOH)⁺ +H⁺
CuCl+HOH↔CuOH
запишем
Кравн для уравнения (2)
Кр= Учитывая,
что концентрация протона водорода равна
[H⁺]=
Учитывая,
что концентрация протона водорода равна
[H⁺]= и подставим в уравнение для константы
равновесия получим константу гидролиза
по катиону.
Константа по катиону
связана с константой ионизации основания.
Чем слабее основания, тем в большей
степени подвергаются гидролизу
образованные им соли.
степень гидролиза
возрастает с повышением температуры и
уменьшением концентрации соли, т.е. с
разбавление раствора.
4) растворы
солей образованы катионами и анионами
слабого основания и слабой кислоты.
Подверг гидролизу и по катиону и по
аниону, характер среды опред относительной
силой кислоты и основания
и подставим в уравнение для константы
равновесия получим константу гидролиза
по катиону.
Константа по катиону
связана с константой ионизации основания.
Чем слабее основания, тем в большей
степени подвергаются гидролизу
образованные им соли.
степень гидролиза
возрастает с повышением температуры и
уменьшением концентрации соли, т.е. с
разбавление раствора.
4) растворы
солей образованы катионами и анионами
слабого основания и слабой кислоты.
Подверг гидролизу и по катиону и по
аниону, характер среды опред относительной
силой кислоты и основания
29. . На конкретных примерах (KCl, MnBr₂, K₃PO₄, PCl₅, Al(CO₃)₃) покажите сущность реакций гидролиза ионных и ковалентных соединений. В чем отличие реакций гидролиза ионных и ковалентных соединений? Под гидролизом понимают реакции обменного разложения обменного разложения между водой и соответствующим элементом. Гидролиз обычно протекает без изменения степени окисления элементов. Сущность гидролиза состоит в том, что катион соли (слабое основание) либо её анион (слабая кислота) связывают соответственно ионы OH или H+ с образованием слабого электролита. Гидролиз ковалентных соединений. при этом происходит полное гидролитическое разложение вещества с образованием двух кислот - кислородосодержащей и бескислородной. просто примеры ковалентных соединений. Na₃PO₄↔3Na⁺+PO₄³⁻ Na⁺+HOH≠ l стадия(ионная) PO₄³⁻+HOH↔[HPO₄]²⁻+OH, pH-щелочная l ст(молек) Na₃ PO₄+HOH↔Na₂HPO₄²⁻ + NaOH ll ст(ион) HPO₄²⁻ +HOH↔[H₂PO₄]⁻ + OH⁻ ll ст(мол) Na₂HPO ₄+ HOH↔ NaH₂PO₄⁻ + NaOH AlCl₃↔Al³⁺ +3Cl⁻ Cl⁻+HOH≠ lст(ион) Al³⁺ +HOH ↔ AlOH³⁺ +H⁺ lст(мол) AlCl₃ + HOH ↔ [AlOH]Cl₂+HCl llст(ион) AlOH²⁺ +HOH ↔ [Al(OH)₂]+H⁺ llст(мол) AlOHCl₂+HOH [Al(OH)₂]Cl+HCl среда щелочная. KCl гидролизу не подвергается, т.к. соль образована катионом сильного основания и анионом сильной. Соль образована слабым основанием и сильной кислотой,гидролиз по катиону: MnBr2 + H2O =MnOHBr + HBr Mn(2+) + H2O = MnOH(+) + H(+) Mn(2+) + 2Br(-) + H2O = MnOH(+) +2Br(-) + H(+); pH<7;среда кислая Соль сильного основания (КOH) и слабой кислоты (H3РO4). Гидролиз по аниону. Среда щелочная. K₃PO₄ + H₂O = K₂HPO₄ + KOH PO₄³⁻ + H₂O = HPO₄²⁻ + OH⁻ K₂HPO₄ + H₂O = KH₂PO₄ + KOH HPO₄²⁻ + H₂O = H₂PO₄⁻ +OH⁻ KH₂PO₄ + H₂O = H₃PO₄ + KOH H₂PO₄⁻ +H₂O = H₃PO₄ + OH⁻ PCl5 + 4H2O = 5HCl + H3PO4 HCl + H2O = Сl− + H3O+ H3PO4 + H2O=H2PO4− + H3O+, pH < 730.
Окислением называют процесс отдачи электронов атомам, молекулам или ионам. Степень окисления при этом повышается.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом. Степень окисления при этом понижается.
Атомы, молекулы и ионы, отдающие электроны называются восстановителями. Сами они при этом окисляются.
Атомы, молекулы и ионы, присоединяющие электроны называются окислителями. Сами они при этом восстанавливаются.
Окисление всегда сопровождается восстановлением (и наоборот).
Правило электронного баланса: число электронов, отдаваемых молекулами, атомами или ионами восстановителя, равно числу электронов, присоединенных молекулами, атомами или ионами окислителя.
Существуют 2 метода составления уравнений окислительно-восстановительных реакций:
а) метод электронного баланса, основанный на сравнении степеней окисления атомов в исходных и конечных веществах. В основе этого метода лежит закон сохранения электрического заряда.
б) метод полуреакций (метод ионно-электронного баланса), основанный на составлении ионных уравнений для процессов окисления восстановителя и восстановления окислителя с последующим суммированием их в общее уравнение. В основе этого метода лежат законы сохранения массы и закон сохранения электрического заряда.
Типы окислительно-восстановительных реакций
Окислительно-восстановительные реакции разделяют на межмолекулярные и внутримолекулярные, в зависимости от того, в состав каких веществ входят окислитель и восстановитель.
Межмолекулярные ОВ реакции характеризуются тем, что окислителем и восстановителем являются различные вещества:
Внутримолекулярные ОВ реакции характеризуются тем, что окислитель и восстановитель входят в состав одного и того же вещества, но представляют собой атомы разных элементов. К ним относится большинство реакций термического разложения:
Реакции самоокисления-самовосстановления. Существует много ОВ реакций, в которых и окислителей и восстановителем являются атомы одного и того же элемента. Эти реакции также могут быть внутри- и межмолекулярными. Такие реакции называются по-разному: самоокисления-самовосстановления, окислительно-восстановительной двойственности, диспропорционирования, дисмутации.
Реакции внутримолекулярной ОВ дисмутации характеризуются тем, что атомы элемента, проявляющего окислительно-восстановительную двойственность, входят в состав одной молекул одного и того же вещества:
30.Реакции протекающие с изменением степени окисления элемента называются –окислительно –восстановительными.
Степень окисления элементов меняется в следствии перехода электронов от одной частиц к другим.
2Na +Cl 2=2NaCL
Na -1e=Na процесс окисления ( Восстановитель)
Cl+1e=Cl процесс восстановления ( Окислитель)
Вещество содержащие элемент у которого в ходе реакции степень окисления понижается,называется ОКИСЛИТЕЛЕМ Вещество содержащие элемент у которого в ходе реакции степень окисления повышается ,называется ВОССТАНОВИТЕЛЕМ ТИПЫ ОВР Типы окислительно-восстановительных реакций.1. Рeакции мeжмолeкулярного окислeния-восстановлeния. В таких рeакциях окислитeль и восстановитeль находятся в разных вeщeствах:
3CuO + 2NH3 = 3Cu + N2 + 3H2O
2. Внутримолeкулярныe ОВР. Сюда относятся рeакции, в которых окислитeль и восстановитeль содeржатся в одном и том жe вeщeствe в видe атомов разных элeмeнтов::
(NH4)2Cr2O7 =N2 + Cr2O3 + 4H2O
3. Рeакции диспропорционирования. В них молeкулы и ионы одного и того жe вeщeства рeагируют друг с другом как окислитeль и восстановитeль.
Вeщeства, участвующиe в рeакциях диспропорционирования содeржат элeмeнт в промeжуточной степени окисления, которая одноврeмeнно повышаeтся и понижаeтся:
2Н2O2 = O2 + 2Н2O
3 HNO2 = HNO3+ 2NO + H2O
4. Рeакции контрпропорционирования – это процeссы взаимодeйствия окислитeля и восстановитeля, содeржащиe один и тот жe элeмeнт в разных стeпeнях окислeния. В рeзультатe продуктом окислeния и продуктом восстановлeния являeтся одно и то жe вeщeство, содeржащee атомы в промeжуточной стeпeни окислeния:
Na2SO3 + 2Na2S + 6HCl = 3S + 6NaCl + 3H2O
Сущeствуют такжe тип окислительно-восстановительных реакцийкоторый нe относится ни к одному из вышe привeдeнных случаeвклассификации ОВР. Это ОВР смeшанного типа. Напримeр, и к внутримолeкулярной рeакции и к рeакции контрпропорционирования относится процeсс разложeния нитрата аммония:
NH4NO3= N2O + 2H2O
почему перманганат калия и бихромат калия выпутают в роле окислителей????
Перманганат калия(КМnO4 ) и бихромат калия (K2Cr2O7) Выступают в роле окислителей т. к ионы молекулы , содержащие атомы элементов в высшей степени окисления- металлов. Сильными окислителями являются металлы находящиеся в 6 и 7 побочных подгруппах.
2KMnO4+5Na2SO3+3H2SO4= 2MnSO4+K2SO4+ Na2SO4+6H2O
Mn(+7)+5е=Mn(+2)
S(+4)-2e=S(+6)
KMnO-окислитель
Na2SO3-восстановитель
К2Cr2O7+3H2S+4H2SO4=Cr2(SO4)3+3S+K2SO4+7H2O
Cr(+6)+6e=2Cr(+3 )
S(-2)-2e=S(0)
К2Cr2O7-окислитель
3H2S-восстановитель
почему KI(-1)и H2S(-2)выпутают в роле восстановителей??
Т.к чем слабее связь между ядром атома и его валентными электронами , тем выше его восстановительная активность. Поэтому в главных подгруппах с увеличением радиуса восстановительные свойства элементов усиливаются.
Анионы не металлов (кислотные остатки бескислородных кислот) могут проявлять высшую восстановительную способность(S -2)
10KI+KMnO4+8H2S=5I2+6K2SO4+8H2O+2MnSO4
2I(-1)-2e=I2(0)
Mn(+7)+5e=Mn(+2)
KMnO4-окислитель
KI-восстановитель
2КMnO4+5H2S+3H2SO4=2MnSO4+5S+K2SO4+8H2O
Mn(+7)+5e=Mn(+2) КMnO4- окислитель
S(-1)-2e=S(0) H2S- восстановитель
