
- •7.Энергия ионизации и сродство к электрону
- •24. Сильные и слабые электролиты
- •26. Равновесие в гетерогенных системах
- •31. Направление окислительно-восстановительных реакций
- •Либо проводят окислительно-восстановительную реакцию:
- •2. Взаимодействие с водородом
- •3. Взаимодействие с водой
- •58. Общая характеристика семейства железа
1.Атом – система, состоящая из ядра и электронной оболочки. Электронная оболочка – совокупность движущихся вокруг ядра электронов Ядра атомов заряжены положительно, но состоят они не только из протонов. Ядра содержат еще и нейтроны. Протоны и нейтроны вместе носят название нуклоны – то есть ядерные частицы. Нуклоны – общее название протонов и нейтронов.
Любой атом в целом электронейтрален, а это значит, что число электронов в электронной оболочке атома равно числу протонов в его ядре.
Общее число нуклонов в ядре называется массовым числом и обозначается буквой А. Число нейтронов в ядре обозначается буквой N, а число протонов - буквой Z. Эти числа связаны между собой простым соотношением: A=Z+N
При химических peaкцияx атомы могут терять часть своих электронов, а могут и присоединять «лишние». При этом из нейтральных атомов образуются заряженные частицы – ионы
Движение и взаимодействия микрочастиц описывает квантовая механика. Она основывается на представление о квантовании энергии волновом характере, движение микрочастиц и вероятностном методе описании микрообъектов.
Энергия распространяется и передаётся ,поглощается и испускается непрерывно, а дискретно, отдельными порциями – квантами. Энергия системы микрочастиц также может принимать только определенные значения, кот. являются кратными числами квантов.
ε=hv
λv=c
Чем меньше длина волны, тем больше энергия кванта.
Поскольку движение электрона имеет волновой характер квантовая механика описывает его движение в атоме при помощи волновой функции. Решением является некие значения волновой функции, которые называются орбиталью. Орбиталью – это область пространства вокруг ядра где наиболее вероятно пребывание электронов. Для описания орбиталей используют квантовые числа.
2.орбиталь можно описать с помощью набора квантовых чисел :n- главное квантовое число, l-орбитальное к.ч., ml- магнитное к.ч.
Главное к.ч. характеризует общую энергию электронов и принимает значение целых чисел.
Может принимать значение чисел натурального ряда. n= 1,2,3 и т.д. Количество квантовых слоев =n(соответствует номеру периода в котором он находится).
Орбитальное к.ч l - характеризует различие в энергии электронных пределов одного энерг.уровня и каждый энерг.уровень расщепляет орбитали каждого подслоя и имеют различные значения орбитали.l=0,1,2,3…(n-1).
Магнитное к.ч. показывает max возможное число орбиталей с данным числом l и характеризует пространственное расположение орбиталей.ml=(2l+1)
Электроны в атоме расположены на энергетических уровнях, которые со- держат различные энергетические подуровни, состоящие, в свою очередь, из определенного количества атомных орбиталей: s- подуровень состоит из одной, р- подуровень ─ из трех, d- подуровень ─ из пяти и f- подуровень ─ из семи орбиталей.
3. Все атомы являются многоэлектронными. Закономерность заполнения электронных оболочек атомов определяется принципом запрета, установленным в 1925 г швейцарским физиком Паули (принцип Паули): В атоме не могут одновременно находиться два электрона с одинаковым набором четырех квантовых квантовых чисел (заполнение электронами орбиталей происходит следующим образом: сначала на каждой орбитали располагается по одному электрону, затем, после заполнения всех орбиталей происходит распределение вторых электронов с противоположным спином). Заселение электронами энергетических уровней, подуровней и атомных орбиталей подчиняется следующему правилу: В невозбужденном атоме все электроны обладают наименьшей энергией (принцип наименьшей энергии). Это означает, что каждый из электронов, заполняющих оболочку атома, занимает такую орбиталь, чтобы атом в целом имел минимальную энергию. Последовательно квантовое возрастание энергии подуровней происходит в следующем порядке: 1s - 2s -2р - 3s – 3р - 4s –3d - 4р - 5s -…. Заполнение атомных орбиталей внутри одного энергетического подуровня происходит в соответствии с правилом, сформулированным немецким физиком Ф. Хундом (1927г) (правило Хунда): При данном значении квантового числа l (т.е. в пределах одного подуровня) в основном состоянии электроны располагаются таким образом, что значение суммарного спина атома максимально. Это означает, что на подуровне должно быть максимально возможное число неспаренных электронов. Порядок возрастания энергии атомной орбитали в сложных атомах описывается правилом Клечковского: энергия атомной орбитали возрастает в соответствии с увеличением n +l главного и орбитального квантовых чисел. При одинаковом значении суммы энергия меньше у атомной орбитали с меньшим значением главного квантового числа. Распределение электронов по различным атомным орбиталям называют электронной конфигурацией атома.ё
4. Нахождение элемента в подгруппе определяется сходством конфигурации внешнего энергетического уровня. От порядка заполнения атомных орбиталей все элементы делятся на s,p,d и f семейства.
S и P химические элементы располагаются в главных подгруппах.
D элементы располагаются в побочных подгруппах.
F элементы – это химические элементы относящиеся к семейству актиноидов и лантаноидов а также побочной подгруппы третьей группы.
Целое число n, обозначающее номер уровня, называется главным квантовым числом и характеризует энергию электронов, занимающих данный энергетический уровень. Число заполненных электронами энергетических уровней в атоме численно равно номеру периода периодической системы, в котором данный атом находится. Наибольшее число электронов на данном энергетическом уровне равно N= 2n2, где N- число электронов, n- номер уровня или главное квантовое число. Согласно этой формуле максимальное число электронов на первом энергетическим уровне равно 2, на втором- 8, на третьем- 18, на четвертом- 32. Во внешнем, последнем электронном слое атома не бывает больше 8 электронов. Строение электронных уровней. Квантовые числа. Принцип Паули. Электронные уровни, начиная с n³2, разделяются на подуровни (подслои). Подуровни отличаются друг от друга энергией связи с ядром. Количество подуровней равно значению главного квантового числа, но не превышает четырех. Каждый подуровень состоит из орбиталей определенного вида, которым соответсвуют определенные значения орбитального квантового числа l. Подуровни со значениями l равными 0, 1, 2, 3 называются соответственно s-, p-, d-, f- подуровнями. В каждом энергетическом уровне наиболее близко к ядру располагается s- подуровень, состоящий из одной s- орбитали. Далее следует р- подуровень, состоящий из трех р- орбиталей. Следующим подуровнем является d- подуровень, вмещающий пять d- орбиталей. Четвертым является f- подуровень, образованный семью f- орбиталями.
5. В периодической системе существуют горизонтальные и вертикальные ряды химических элементов.
Период – это горизонтальный ряд химических элементов, расположенные в порядке возрастания заряда атомного ядра. У химических элементов находящихся в одном периоде атомы имеют одинаковое количество энергетических уровней. Всего существует семь периодов. Различают малые и большие периоды химических элементов.
Малые периоды содержат один ряд химических элементов.
Большие периоды содержат по два ряда химических элементов.
Каждый период начинается со щелочного металла и заканчивается инертным газом. Изменение свойств химических элементов в пределах периода называется горизонтальной периодичностью.
Группа – вертикальные ряды, химические элементы в которых имеют одинаковое количества электронов на внешнем энергетическом уровне.
Нахождение элемента в подгруппе определяется сходством конфигурации внешнего энергетического уровня. От порядка заполнения атомных орбиталей все элементы делятся на s,p,d и f семейства.
S и P химические элементы располагаются в главных подгруппах.
D элементы располагаются в побочных подгруппах.
F элементы – это химические элементы относящиеся к семейству актиноидов и лантаноидов а также побочной подгруппы третьей группы.
Изменение свойств в пределах группы химических элементов называется вертикальной периодичностью.
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Периодические свойства химических элементов
Большинство этих свойств проявляет явную периодическую зависимость от атомных номеров химических элементов[9]. Среди этих свойств наиболее важными, имеющими особое значение при объяснении или предсказании химического поведения элементов и образуемых ими соединений являются:
энергия ионизации атомов;
энергия сродства атомов к электрону;
электроотрицательность;
атомные (и ионные) радиусы;
энергия атомизации простых веществ
степени окисления;
окислительные потенциалы простых веществ.
6.Радиусы атомов Зависящие от радиусов атомов энергии атомных орбиталей, точнее, энергии электронов, находящихся на различных орбиталях (орбитальные энергии), определяются взаимным притяжением ядра и электронов, взаимным отталкиванием электронов и отражают размеры и электронное строение атома. В группах для однотипных элементов при движении сверху вниз наблюдается закономерный рост орбитальных радиусов, что связано с увеличением числа электронных оболочек. В периодах при движении слева направо прослеживается, как правило, уменьшение орбитальных радиусов.
В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром. В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек.
Степень окисления - это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные.
Понятие ЭО является условным.оно позволяет оценить способность атома данного элемента оттягивать на себя электронную плотность по сравнению с атомами других элементов в соединении.
Степень окисления - формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
Под степенью окисления атома в молекуле понимается условный электрический заряд данного атома, вызванный смещением валентных электронов к более электроотрицательному атому.
Степень окисления атома обозначается числом со знаком ( + ) или ( - ) .
В отличие от рассмотренных выше молекул в молекулах, состоящих из одинаковых атомов (H2, Cl2, Br2, N2 и др. ), степень окисления атомов равна нулю, так как здесь не имеет места одностороннее оттягивание общих пар электронов к какому-либо одному атому
7.Энергия ионизации и сродство к электрону
В химических реакциях поведение атомов и ионов в значительной мере зависит от того, насколько прочно у них электроны удерживаются на своих энергетических уровнях. Электроны связаны с ядром энергией, величина которой зависит от того, на каком уровне расположены электроны. Чем выше уровень, на котором находится электрон, тем меньше энергия связи.
Потенциал ионизации зависит в основном от величины заряда ядра и радиуса атома. Чем больше радиус атома, тем слабее притягивается электрон к ядру, а следовательно, и меньше энергии необходимо затратить на отрыв электрона и превращение атома в положительный ион.
Различное изменение потенциалов ионизации главных и побочных подгрупп можно объяснить следующим образом. У атомов элементов главных подгрупп по мере увеличения порядкового номера увеличивается радиус атома, т. е. расстояние отрываемых электронов от ядра, а следовательно, ослабляется связь этих электронов с ядром и поэтому уменьшаются потенциалы ионизации.
Сродство к электрону служит мерой окислительной способности атома: чем больше сродство атома к электрону, тем более сильным окислителем он является, так как наиболее легко присоединяет электрон.
Атомы металлов не принимают электроны; напротив, атомы неметаллов способны присоединять электроны. Причем сродство к электрону у них тем больше, чем ближе к инертному элементу неметалл в периодической системе, т. е. в пределах периода неметаллические свойства усиливаются слева направо.
Сродством атома к электрону называется энергетический эффект присоединения электрона к нейтральному атому с превращением его в отрицательный ион.
8. Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга.
Частицы, которые принимают участие в образовании химических связей, могут быть атомами, молекулами или ионами.
Длина химической связи При образовании химической связи всегда происходит сближение атомов - расстояние между ними меньше, чем сумма радиусов изолированных атомов: r(A−B) < r(A) + r(B)
Межъядерное расстояние между химически связанными атомами называется длиной химической связи.
Расстояние между атомами существенно уменьшается при образовании кратных связей. Чем выше кратность связи, тем короче межатомное расстояние.
Энергия связи. Химическая связь возникает лишь в том случае, если полная энергия взаимодействующих атомов уменьшается, т.е. при образовании связи должна всегда выделяться энергия.
Количество энергии, выделяющейся при образовании химической связи, называется энергией связи EСВ (кДж/моль).
Энергия связи является мерой прочности связи. Чем больше выделяется энергии при образовании молекулы, тем больше энергии надо затратить на разрыв, т.е. тем молекула прочнее.
Водородная связь
Водородные связи могут образовываться между атомом водорода, связанным с атомом электроотрицательного элемента, и электроотрицательным элементом, имеющим свободную пару электронов(О,F,N). Водородная связь обусловлена электростатическим притяжением, которому способствуют малые размеры атома водорода, и отчасти, донорно-акцепторным взаимодействием. Связи 0-Н имеют выраженный полярный характер: Водородная связь гораздо более слабая, чем ионная или ковалентная, но более сильная, чем межмолекулярное взаимодействие. Различают водородную связь: межмолекулярную и внутримолекулярную.
Металлическая связь При обычных условиях металлы, за исключением ртути Hg, существуют в виде кристаллов. Взаимодействие, удерживающее атомы металлов в едином кристалле, называется металлической связью.
Природа металлической связи подобна ковалентной связи: оба типа связи основаны на обобществлении валентных электронов. Однако в атомах металлов количество таких электронов меньше количества вакантных орбиталей. Электроны слабо удерживаются ядром. Поэтому они могут переходить из одной орбитали в другую. Стремясь принять более устойчивое состояние, а это структура инертного газа, атомы металлов довольно легко отдают валентные электронные электроны, превращаясь в положительно заряжённые ионы. Благодаря свободному перемещению электронов металлы обладают высокой электрической проводимостью и теплопроводностью.
Ионная связь
Химическая связь, осуществляемая за счет электростатического притяжения между ионами, называется ионной связью. Соединения, образованные путем притяжения ионов называются ионными. Ионные соединения состоят из отдельных молекул только в парообразном состоянии. В твердом (кристаллическом) состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. Молекулы в этом случае отсутствуют. Ионная связь образуется между элементами сильно отличающимися по электроотрицательности.Ионная связь образуется за счет перехода одного или нескольких электронов от одного атома на внешнюю оболочку другого атома.
Образование ионной связи происходит по октаэдрическому правилу. Согласно этому правилу атом принимает, теряет или разделяет электроны таким образом, чтобы электронное облако для него соответствовало ближайшему инертному газу.
Ковалентная связь. Тип химической связи между атомами, возникающей при обобществлении электронов, которые принадлежат этим атомам.
Для объяснения ковалентной связи используют 2 метода квантово-механического расчета:
метод валентных связей (МВС)
метод молекулярных орбиталей (ММО)
Согласно методу валентных связей ковалентная связь образуется не путем передачи, а путем обобществления неспаренных электронов с антипараллельными спинами по 1-му от каждого атома. Образовавшаяся в этом случае электронная пара принадлежит обоим атомам. Чем в большей степени перекрываются атомные орбитали, тем прочнее связь.
Перекрывание атомных орбиталей возможно лишь при их определенной взаимной ориентации в пространстве. Ковалентная связь в отличие от ионной имеет направленность.
9. ковалентная связь образуется м/у 2-мя атомами парой электронов, принадлежащих обоим атомам. Эта связь образуются между атомами неметаллов. Различают полярную связь, когда взаимодействуют атомы разных электронов с разными электронами и ковалентно-неполярная , когда взаимод.атомы одинаковых неметаллов с одиннаковми электронами. Вещества с ковалентн. связью имеют атомно-молекулярную и молекулярную кристаллическую решетку.
Одно из существенных свойств ковалентной связи - ее насыщаемость. При ограниченном числе внешних электронов в областях между ядрами образуется ограниченное число электронных пар вблизи каждого атома (и, следовательно, число химических связей). Именно это число тесно связано с понятием валентности атома в молекуле (валентностью называют общее число ковалентных связей, образуемых атомом
Механизмы образования ковалентных связей Различают несколько механизмов образования ковалентной связи: обменный (равноценный), донорно-акцепторный, дативный.
При использовании обменного механизма образование связи рассматривается как результат спаривания спинов свободных электронов атомов. При этом осуществляется перекрывание двух атомных орбиталей соседних атомов, каждая из которых занята одним электроном. Таким образом, каждый из связываемых атомов выделяет для обобществления пары по электрону, как бы обмениваясь ими.
По донорно-акцепторному механизму перекрывается орбиталь с парой электронов одного атома и свободная орбиталь другого атома. В этом случае в области перекрывания также оказывается пара электронов. По донорно-акцепторному механизму происходит, например, присоединение фторид-иона к молекуле трифторида бора. Атомы, внешняя электронная оболочка которых состоит только из s- и р-орбиталей, могут быть либо донорами, либо акцепторами электронной пары. Атомы, у которых внешняя электронная оболочка включает d-орбитали, могут выступать в роли и донора, и акцептора пар электронов. В этом случае рассматривается дативный механизм образования связи. Примером проявления дативного механизма при образования связи служит взаимодействие двух атомов хлора.
Валентность - это свойство атома одного элемента присоединять, удерживать или замещать в химических реакциях определенное количество атомов другого элемента. За единицу валентности принята валентность атома водорода. Поэтому приведенное определение иногда формулируют так: валентность - это свойство атома данного элемента присоединять или замещать определенное количество атомов водорода.
10.НАПРАВЛЕННОСТЬ — свойство ковалентной связи, определяющее геометрическую структуру молекулы. Причина направленности связи заключается в том, что перекрывание электронных орбиталей возможно только при их определенной взаимной ориентации, обеспечивающей наибольшую электронную плотность в области их перекрывания. В этом случае образуется наиболее прочная химическая связь.
Валентные углы
Направление ковалентных связей характеризуется валентными углами - углами между линиями, соединяющими связываемые атомы. Графическая формула химической частицы не несет информации о валентных углах. Совокупность длин связей и валентных углов в химической частице определяет ее пространственное строение. Для определения валентных углов используют экспериментальные методы изучения структуры химических соединений. Оценить значения валентных углов можно теоретически, исходя из электронного строения химической частицы.
σ– связь может возникать при перекрывании s- орбиталей, s- и р- орбиталей, р- орбиталей, d- орбиталей, а также d- и s- орбиталей, d- и р– орбиталей. σ– связь обычно объединяет два атома, поэтому является локализованной двухцентровой связью.
Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов, называется π– связью (пи связь). π– связь может образоваться при перекрывании р-р- орбиталей, р-d- орбиталей, d-d- орбиталей , а также f-p-, f-d- и f-f- орбиталей.
Связь, образованная перекрыванием d- орбиталей всеми четырьмя лепестками, называется δ- связью (дельта связь)
Соответственно, s- элементы могут образовывать лишь σ– связи, р- элементы - σ– и π– связи, d- элементы - σ–, π– и δ‑ связи, а f- элементы - σ– , π– , δ- и еще более сложные связи. При наложении π– связи на σ- связь образуется двойная связь, например в молекулах кислорода, этилена, диоксида углерода.
При наложении двух π– связей на σ- связь возникает тройная связь, например в молекулах азота, ацетилена и оксида углерода. Число связей между атомами в методе ВС называется кратностью связи.
π-связи в молекулах или ионах, у которых возможно несколько способов локализации связей между атомами, называются делокализованными связями.
CH4. Тип гибридизации sp3,число орбиталей 4, Тетраэдрическая , Атом С образует 4 связи, находясь в возбуждённом состоянии с электронной конфигурацией 1s22s2р3. Состояние 4-валентных электронов 2s2p3 описывают разл. одноэлектронные ф-ции
Be+2H2-1
2. Запишем сокращенные электронные конфигурации атомов и условных ионов:
Be 1s22s22p0 Be+2 2s02p0
H 1s1 H-1 1s2
3. Для того, чтобы атом бериллия образовал две связи, необходимо, чтобы он имел два неспаренных электрона. Это происходит при переходе атома в возбужденное состояние, электронная конфигурация будет
Be* 1s22s12p1
4. Связи Be–H в молекуле BeH2 равнозначны, поэтому предполагается, что у атома бериллия одна 2s- и одна 2p-орбитали гибридизуются в две sp-орбитали, которые расходятся в пространстве на максимально возможное расстояние (180°).
5. Гибридизованные орбитали перекрываются с 1s-орбиталями двух атомов водорода, в результате чего образуется линейная молекула BeH2.
Молекула BH3
1. B+3H3-1
2. B+3 (2s02p0) и H-1 (2s2)
3. У атома бора одна 2s- и две 2p-орбитали гибридизуются в три sp2-гибридные орбитали, которые расходятся в пространстве на угол 120°. Форма молекулы – треугольная.
Молекула CH4
1. C-4H+1
2. C-4 (2s22p2) H+1 (1s0)
11.Валентные углы
Направление ковалентных связей характеризуется валентными углами - углами между линиями, соединяющими связываемые атомы. Графическая формула химической частицы не несет информации о валентных углах. Совокупность длин связей и валентных углов в химической частице определяет ее пространственное строение. Для определения валентных углов используют экспериментальные методы изучения структуры химических соединений. Оценить значения валентных углов можно теоретически, исходя из электронного строения химической частицы
Пространственная конфигурация молекул
Если на внешней оболочке атома имеются два электрона, один в s- состоянии а другой в р- состоянии, то при затрате некоторой энергии вместо исходных s- и р- орбиталей могут образоваться две гибридные sp- орбитали (рис. 9). Они вытянуты вдоль прямой в противоположных направлениях.
При образовании молекул элементами IV группы главной подгруппы валентные электроны подвергаются sp3–гибридизации Гибридная орбиталь способна к более сильному перекрыванию с орбиталями других атомов и образованию более прочных связей. Гибридные орбитали расположены в пространстве под углом 109°28’ и направлены к вершинам тетраэдра. Аналогичное строение имеют молекулы SiCl4 и т. п.
НАПРАВЛЕННОСТЬ — свойство ковалентной связи, определяющее геометрическую структуру молекулы. Причина направленности связи заключается в том, что перекрывание электронных орбиталей возможно только при их определенной взаимной ориентации, обеспечивающей наибольшую электронную плотность в области их перекрывания. В этом случае образуется наиболее прочная химическая связь.
12 Кратность ковалентной связи проявляется в том, что два атома могут связываться между собой более чем одной ковалентной связью.
Связь двух атомов может осуществляться более чем одной парой электронов. Такая связь называется кратной. Примером образования кратной связи может служить молекула азота. В молекуле азота px-орбитали образуют одну σ-связь. При образовании связи pz-орбиталями возникают две области перекрывания – выше и ниже оси х:
Такая связь называется пи-связью (π-связь). Возникновение π-связи между двумя атомами происходит только тогда, когда они уже связаны σ-связью. Вторую π-связь в молекуле азота образуют ру-орбитали атомов. При образовании π-связей электронные облака перекрываются меньше, чем в случае σ-связей. Вследствие этого π-связи, как правило, менее прочны, чем σ-связи, образованные теми же атомными орбиталями.
р-орбитали могут образовывать как σ-, так и π-связи; в кратных связях одна из них обязательно является σ-связью: .
Таким образом, в молекуле азота из трех связей одна - σ-связь и две - π-связи.
σ– связь может возникать при перекрывании s- орбиталей, s- и р- орбиталей, р- орбиталей, d- орбиталей, а также d- и s- орбиталей, d- и р– орбиталей. σ– связь обычно объединяет два атома, поэтому является локализованной двухцентровой связью.
Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов, называется π– связью (пи связь). π– связь может образоваться при перекрывании р-р- орбиталей, р-d- орбиталей, d-d- орбиталей , а также f-p-, f-d- и f-f- орбиталей.
Связь, образованная перекрыванием d- орбиталей всеми четырьмя лепестками, называется δ- связью (дельта связь)
Соответственно, s- элементы могут образовывать лишь σ– связи, р- элементы - σ– и π– связи, d- элементы - σ–, π– и δ‑ связи, а f- элементы - σ– , π– , δ- и еще более сложные связи. При наложении π– связи на σ- связь образуется двойная связь, например в молекулах кислорода, этилена, диоксида углерода.
При наложении двух π– связей на σ- связь возникает тройная связь, например в молекулах азота, ацетилена и оксида углерода. Число связей между атомами в методе ВС называется кратностью связи.
π-связи в молекулах или ионах, у которых возможно несколько способов локализации связей между атомами, называются делокализованными связями.
13. полярность ков.св.-это признак ков.связи обусловленный неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. Полярные молекулы являются диполями,т.е. системами,состоящими из двух равных по величине и противоположных по знаку зарядов,находящихся на некотором расстоянии друг от друга. Неполярные молекулы-это молекулы симметричного строения,центры «тяжести» (+Q) и (-Q) зарядов в отсутствии электрического поля совпадают.Дипольный момент=0. NF3 – тригонально-пирамидальная, полярная, дипольный момент=0,07 * 10 в степени -29;заряды компенсируются за счет формы молекулы. ( 5 электр.+1*3=8:2=4 ЛЭП,3 СЭП,1 НЭП) BeСL2 – линейная,неполярная. (2 электр.+1*2=4:2=2 ЛЭП,2СЭП,0НЭП)
14.Тепловые эффекты химических реакций. Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она сопровождается выделением или поглощением энергии в виде теплоты, света, работы расширения образовавшихся газов.
По признаку выделения или поглощения теплоты реакции делятся на экзотермические и эндотермические.
Количество теплоты, которое выделяется или поглощается в результате реакций между определенными количествами реагентов, называют тепловым эффектом химической реакции и обычно обозначают символом Q.
Наряду с тепловым эффектом термохимические процессы очень часто характеризуют разностью энтальпий D H продуктов реакции и исходных веществ.
Энтальпия Н — это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании.
При экзотермических реакциях, когда тепло выделяется, D Н отрицательно. При эндотермических реакциях (тепло поглощается) и D H положительно.
Термохимические уравнения. На первых этапах изучения химии вы часто пользовались равным по абсолютной величине и противоположным по знаку обозначением, например:
где Q — количество выделенной теплоты. Если использовать энтальпию (характеристику энергосодержания системы), то это уравнение следует записать иначе
Теплота образования химических соединений. Теплотой образования соединения называется количество теплоты, которое выделяется или поглощается при образовании одного моля химического соединения из простых веществ при стандартных условиях (р = 105 Па, T = 298 К). Она измеряется в кДж/моль. Согласно этому определению, теплота образования простого вещества при стандартных условиях равна О.
Изменение энтальпии D Н зависит от давления и температуры. Поэтому для того, чтобы облегчить сравнение термохимических данных для различных реакций, были приняты определенные стандартные состояния (условия).
При написании термохимических уравнений твердое вещество, жидкость и газ обязательно обозначаются символами (тв), (ж) и (г) соответственно, поскольку изменение энтальпии зависит от агрегатного состояния реагирующих веществ и продуктов реакции.
Закон Гесса и его следствия. Важнейшим законом, на котором основано большинство термохимических расчетов, является закон Гесса (его называют также законом суммы тепловых эффектов).
Тепловой эффект химической реакции зависит от состояния исходных веществ и продуктов реакции, но не зависит от промежуточных стадий реакций.
Реакции, сопровождающиеся выделением энергии, называются экзотермическими, реакции, требующие притока энергии извне, называются эндотермическими.
15.Энтропия - это мера неупорядоченности, мера беспорядка системы. С повышением температуры энтропия всегда возрастает. Она также возрастает при превращении вещества из кристаллического состояния в жидкое и, в особенности, при переходе их жидкого состояния в газообразное. Подобно внутренней энергии и энтальпии, энтропия зависит только от состояния системы, но связь изменения энтропии с теплотой зависит от скорости процесса.
Изменение энтропии в химических реакциях вычисляют как разность между энтропиями конечного и начального состояний системы.
Энтальпия и энтропия отражают два противоположно направленных процесса любой системы. Если ΔН отражает в основном взаимодействие атомов в молекуле, стремление простых молекул к объединению в более крупные, т.е. стремление системы к состоянию с минимальным значением энергии, то ΔS отражает совсем противоположную тенденцию а именно, стремление к разрушению агрегатов и к беспорядочному расположению частиц.
Достижение системой минимальной энергии может быть только при ΔS=0. При ΔН=0 система самопроизвольно переходит в наиболее неупорядоченное состояние.
Стремление системы к минимальной энергии заставляет частицы взаимодействовать друг с другом и образовывать устойчивые агрегаты с наименьшим объемом, а тепловое движение расталкивает частицы увеличивая объем системы. В состоянии равновесия обе тенденции становятся равными, фактор энтальпии ΔН и фактор энтропии ΔS компенсирует друг друга.
16. Энергия Гиббса
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж): ΔG = ΔH – T ΔS
При ΔG < 0 реакция термодинамически разрешена и система стремится к достижению условия ΔG = 0, при котором наступает равновесное состояние обратимого процесса; ΔG > 0 указывает на то, что процесс термодинамически запрещен.
Если ΔH < 0 и ΔS > 0, то всегда ΔG < 0 и реакция возможна при любой температуре.
Если ΔH > 0 и ΔS < 0, то всегда ΔG > 0, и реакция с поглощением теплоты и уменьшением энтропии невозможна ни при каких условиях.
В остальных случаях (ΔH < 0, ΔS < 0 и ΔH > 0, ΔS > 0) знак ΔG зависит от соотношения ΔH и TΔS. Реакция возможна, если она сопровождается уменьшением изобарного потенциала; при комнатной температуре, когда значение T невелико, значение TΔS также невелико, и обычно изменение энтальпии больше TΔS. Поэтому большинство реакций, протекающих при комнатной температуре, экзотермичны. Чем выше температура, тем больше TΔS, и даже эндотермические реакции становятся осуществляемыми.
17. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому.
Прямая реакция - экзотермическая, а обратная реакция - эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:
При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции.
18. Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы. Гетерогенной — система, состоящая из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства системы изменяются скачком.
Скорость гомогенной реакции определяется количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объёма системы.
Скорость гетерогенной реакции определяется количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице поверхности фазы.
Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентрации.
Скорость реакции принимается всегда положительной, поэтому производная исходных концентраций берется со знаком минус, а продуктов реакции – со знаком плюс.
Порядок реакции. Порядок реакции - это эмпирическая величина, равная сумме показателей степеней, с которыми концентрации реагентов входят в выражение для скорости реакции.
Реакции первого порядка. Если скорость реакции зависит от концентрации только одного реагента в первой степени, то выражение для скорости принимает вид
![]()
О такой реакции говорят, что она является реакцией первого порядка.
Одним из изменении скорости реакции является катализатор. Катализатор изменяет путь по которому протекает суммарная реакция. Увеличение скорости связано с уменьшением энергии Гиббса.
Из этих трех стадий самая медленная - первая. Поэтому именно она определяет скорость всей реакции (является лимитирующей стадией).
Если лимитирующую стадию нельзя четко выделить, то порядки реакций могут получиться дробными или отрицательными.
Состоит из 3 стадий:
1)поверх кислорода углерода
2)химические реакция на поверх углерода
3)отвод продуктов
Все 3 стадия проходят с разными скоростями.
Энергия данной стадии не большая. данный процесс опред.ся переносом вещества(кислорода к поверхности углерода). И скорость данного процесса опред.ся стадией переноса вещества.
Стадия опред.ся скоростью протекания химический реакции и наз.ся лимитирующей стадией.
При постоянной температуре скорость химическойреакции пропорциональна произведению хим.реакции реагирующих веществ.
19.Обратимым процессом называется равновесный процесс, который в прямом и обратном направлениях протекает через одни и те же промежуточные состояния, а сама система возвращается в исходное состояние.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Примеры необратимых процессов: диффузия, термодиффузия, теплопроводность, вязкое течение и др. Переход кинетической энергии макроскопического движения через трение в теплоту, то есть во внутреннюю энергию системы, является необратимым процессом.
Многие процессы протекают в прямом и обратимом состоянии. При прямом способствует дельта Н.
В определенный момент времени оба фактора уравновешиваются, и наступает момент химического равновесия.
В равновесной системе протекает одновременно исходные вещества и продукты.
Константа химического равновесия. Если реакции гомогенные:
2NO2(г)+О2(г)=2NО3(г)
V1=k1[NO]2[O2]
V2=k2[NO2]2 v1/v2=kc-константа равновесия k1[NO]2[O2]= k2[NO2]2 k1/ k2= kc
20.
.Принцип
Ла Шателье: если находящаяся в равновесии
система подвергается внешнему воздействию,
равновесие смещается в таком направлении,
которое способствует ослаблению этого
воздействия. При повышении температуры
химическое равновесие смещается в
направлении эндотермической реакции,
при понижении температуры — в
направлении экзотермической реакции.
При повышении давления равновесие
сдвигается в направлении, в котором
уменьшается суммарное количество молей
газов и наоборот. При повышении
концентрации одного из исходных веществ
равновесие сдвигается в направлении
образования продуктов реакции. При
повышении концентрац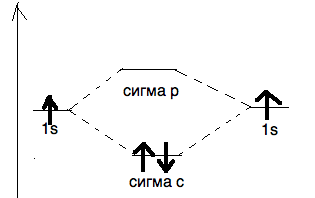 ии
одного из продуктов реакции равновесие
сдвигается в направлении образования
исходных веществ.
ии
одного из продуктов реакции равновесие
сдвигается в направлении образования
исходных веществ.
4Cl(г)+О2(г)=2Сд2(г)+2Н2О(ж) ∆H>0
Равновесие системы сдвигается в сторону продуктов при: понижении температуры, при повышении давления, при повышении концентрации исходных продуктов.
21. В основном реакции в природе происходят в растворах, которые имеют различный состав и структуру. Растворы являются особым видом смесей химических веществ. Основные признаки растворов – это однородность и устойчивость во времени.
Истинные растворы – гомогенные, термодинамические, устойчивые системы, которые состоят из растворённого вещества и растворителя, а также продуктов их взаимодействия. Раствор всегда состоит из 2-х и более компонентов.
Растворитель – это компонент, фазовое состояние которого не изменяется при растворении. Основной растворитель – это вода.
По отношению к воде различают гидрофильные и гидрофобные вещества.
По агрегатному состоянию растворы классифицируются на:
газообразные;
жидкие;
твёрдые.
По качественному составу растворы подразделяются на:
концентрированные, разбавленные;
насыщенные (равновесные, термодинамические, малоустойчивые системы, характеризующиеся максимальным (предельным) растворением вещества без образования осадка);
перенасыщенные (растворённое вещество выпадает в осадок);
ненасыщенные (вещество ещё может раствориться).
диффузия – это самопроизвольный процесс переноса частиц растворенного вещества и растворителя по градиенту концентрации растворенного вещества, приводящий к выравниванию концентраций частиц и их скоростей.
Причина: стремление системы к максимальной энтропии. Несмотря на хаотический характер теплового движения частиц в системе, диффузия частиц как результат этого движения всегда направлена от большей концентрации к меньшей. Направленный характер диффузия имеет до тех пор, пока есть различия в концентрации частиц в отдельных частях системы. После выравнивания концентрации частиц происходит выравнивание и скоростей их диффузии в разных направлениях.
Количество вещества, переносимого за счет диффузии через единичную площадь поверхности в единицу времени, называется скоростью диффузии. Скорость диффузии прямо пропорциональна температуре и разности концентраций по обе стороны поверхности, через которую осуществляется диффузия. В то же время скорость диффузии обратно пропорциональна вязкости среды и размеру частиц.
Осмотическим давлением (π) называют избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью.
При осмосе молекулы растворителя преимущественно движутся через мембрану в том направлении, где концентрация частиц вещества больше, а концентрация растворителя меньше. Другими словами, в результате осмоса происходит всасывание растворителя в ту часть системы, где концентрация частиц вещества больше. Если осмотическое давление у растворов одинаковое, то они называются изотоническими и между ними происходит подлинно равновесный обмен растворителем. В случае контакта двух растворов с разным осмотическим давлением гипертоническим раствором называется тот, у которого осмотическое давление больше, а гипотоническим – раствор с меньшим осмотическим давлением. Гипертонический раствор всасывает растворитель из гипотонического раствора, стремясь выровнять концентрации вещества путем перераспределения растворителя между контактирующими растворами.
Давление пара, при котором в условиях определенной температуры наступает динамическое равновесие, характеризующееся равенством скоростей испарения и конденсации жидкости, называется давлением насыщенного пара.
относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества, т.е. отношению количества молей растворенного вещества к суммарному количеству молей растворенного вещества и растворителя (I закон Рауля)
22.Кипения раствора одного моля вещества в 1000 г растворителя, и часто называется молекулярным повышением температуры кипения. В действительности же уравнение перестает быть правильным при высоких концентрациях растворенных веществ, поскольку в основу этого уравнения положены приближения разбавленных растворов.
Жидкость закипает при температуре, при которой давление насыщенного пара жидкости становится равным внешнему давлению. Так как давление насыщенного пара растворов нелетучих или малолетучих веществ меньше давления насыщенного пара растворителя, то эти растворы кипят при более высокой температуре, чем растворитель. Для разбавленных растворов таких веществ Рауль установил, что повышение температуры кипения раствора Δtк. = t - t0 пропорционально его моляльности:
Δtк. = Е · m
Жидкость замерзает при той температуре, при которой давление насыщенного пара над ней такое же, как и над кристаллами этого вещества. Так как давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем, то разбавленный раствор будет замерзать при более низкой температуре, чем растворитель. Температурой замерзания раствора считают ту температуру, при которой в процессе охлаждения начинают выделяться первые кристаллы чистого растворителя. Для таких растворов Рауль нашел, что понижение температуры замерзания раствора Δtз. = t0 - t (t0 - температура замерзания растворителя, t - температура замерзания раствора) пропорционально его моляльности (1 моль в 1000 г растворителя):
Δtз = К · m,
23. Электролитами называются вещества, диссоциирующие в воде, других полярных жидкостях или расплавах на ионы и способные проводить электрический ток. Распад вещества на ионы называется электролитической диссоциацией. Перенос тока в растворах и расплавах осуществляется ионами, поэтому их в отличие от электронных проводников называют ионными проводниками или проводниками второго рода. К электролитам относят соли, кислоты, основания.
Особенности растворов электролитов. Растворы электролитов, кроме способности проводить электрический ток имеют и другие особенности. В частности, в растворах электролитов наблюдаются отклонения от законов Рауля и Вант-Гоффа
РАСТВОРЫ ЭЛЕКТРОЛИТОВ, содержат в заметных концентрациях ионы-катионы и анионы, образующиеся в результате электролитической диссоциации молекул растворенного вещества. Растворитель (чистый или смешанный) обычно в сколько-нибудь значительной степени не диссоциирован. РАСТВОРЫ ЭЛЕКТРОЛИТОВ э. обладают способностью проводить электрич. ток и относятся к проводникам второго рода. Благодаря увеличению общего числа частиц коллигативные свойства бесконечно разбавленных РАСТВОРЫ ЭЛЕКТРОЛИТОВ э. (т. е. свойства, зависящие только от концентрации растворенного вещества, но не от его природы) существенно отличаются от тех же свойств растворов не электролитов. Этим, в частности, объясняется увеличение осмотич. давления в сравнении со значением, предсказываемым законом Вант-Гоффа (см. Осмос), понижение давления пара растворителя над раствором в сравнении с предсказываемым Рауля законом и др. Наличием ионов обусловлены также классификация РАСТВОРЫ ЭЛЕКТРОЛИТОВэ., особенности теоретич. подходов в сравнении с другими классами растворов. Наиб. изучены водные РАСТВОРЫ ЭЛЕКТРОЛИТОВэ., играющие важную роль во многих биологическое, геол. и техн. процессах. Неводные РАСТВОРЫ ЭЛЕКТРОЛИТОВэ. служат средой для проведения синтеза и электрохимический процессов, используются в современной технологиях (создание новых химических источников тока, солнечных батарей, процессы разделения веществ и др.).
Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает до некоторого целочисленного значения.
Для объяснения особенностей свойств растворов электролитов С.Аррениус предложил теорию электролитической диссоциации, основывающуюся на следующих постулатах:
1.Электролиты в растворах распадаются на ионы – диссоциируют;
2. Диссоциация является обратимым равновесным процессом;
3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными). Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность. Для оценки полноты диссоциации в теории электролитической диссоциации вводится понятие степень диссоциации α, которая равна отношению числа молекул n, распавшихся на ионы, к общему числу молекул N:альфа=n\N
