
- •25. Общее начало термодинамики.
- •6. Понятие температуры. Шкала температур.
- •7. Абсолютная термодинамическая шкала температур.
- •28. Внутренняя энергия системы.
- •9. Работа.
- •30. Теплота.
- •31. Первое начало термодинамики.
- •32. Калорическое и термическое уравнения состояния.
- •33. Теплоемкость.
- •34. Вывод соотношения для .
- •35. Вывод соотношения для в случае идеального газа.
- •36. Основные термодинамические процессы.
- •37. Основные термодинамические процессы для идеального газа.
- •44. Термодинамический потенциал – внутренняя энергия u(s,V).
- •45. Термодинамический потенциал – свободная энергия u(s,V).
- •46. Термодинамический потенциал – потенциал Гиббса u(s,V).
- •47. Термодинамический потенциал – энтальпия u(s,V).
37. Основные термодинамические процессы для идеального газа.
Рассмотрим случай простой ТДС: а, F, T.
Термодинамический процесс (ТДП) называется переход ТДС из одного ТД равновесного состояния в другое.
Равновесный термодинамический процесс (ТДП) – состояние из последовательных равновесных состояний.
Изменять на бесконечно малую величину параметры системы и ждать наступление ТДРС.
Рассмотрим ТД процессы в этой простой ТДС.
В ней известны 5 РТД процессов:
1. РТД процесс, не производящий теплообмена с окружающей средой δQ = 0 адиабатический;
2. РТД процесс при Т = const изотермический;
3. РТД процесс при постоянной теплоёмкости С = const политропный;
Оставшиеся 2 процесса определяются для частных случаев.
4. РТД процесс при V = const изохорический;
5. РТД процесс при p = const изобарический.
Эти 5 процессов называют основными РТД процессами в термодинамике.
Уравнением процесса называется функциональная связь между любыми 2я параметрами из 3х: Т, а, F.
38. Уравнение политропического процесса.
Уравнение политропического процесса имеет след. вид:
pVn = const (1)
n – показатель политропности
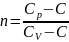 (2)
(2)
39. Уравнение адиабатического процесса.
Уравнение адиабатического процесса (C=0):
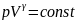 (1)
(1)
 – показатель
адиабата
– показатель
адиабата
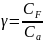 (2)
(2)
40. Уравнение политропы и адиабаты для идеального газа.
Уравнение политропического процесса имеет след. вид:
C=const;
pVn = const (1)
n – показатель политропности
(2)
Уравнение адиабатического процесса:
C=0
(1)
– показатель адиабата
 (2)
(2)
41. Второе начало термодинамики в формулировке Клаузиуса:
в круговом процессе энтропия равна нулю.
 =0
=0
Такая формулировка второго начала термодинамики доказывает невозможность создания вечного двигателя второго рода.
42. Энтропия.
Энтропия – это ф-я состояния ТДС, которая определяется след. образом:
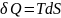 (1)
(1)
энтропия при работе в замкнутом контуре=0
Ф-я
состояния ТДС, определяемая с помощью
дифференциального соотношения
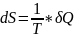 (2)
наз-ся энтропией.
(2)
наз-ся энтропией.
43. Первое и второе начала термодинамики для элементарного процесса.
Элементарный процесс – передача энергии системе, связанной с бесконечным изменением её внутренних и внешних параметров.
Элементарный процесс записывается след. образом:
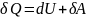 (1)
– это закон сохранения энергии
(1)
– это закон сохранения энергии
Закон сохранения энергии (1) – это первое начало термодинамики для элементарного процесса.
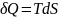
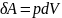
 (2)
– объединяет
1 и 2 начало.
(2)
– объединяет
1 и 2 начало.
Уравнение (2), объединяющее 1 и 2 начало ТД наз-ся основным уравнением термодинамики для равновесных ТД процессов.
44. Термодинамический потенциал – внутренняя энергия u(s,V).
Термодинамические потенциалы (термодинамические функции) — характеристическая функция в термодинамике, убыль которых в равновесных процессах, протекающих при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе.
Все термодинамические потенциалы выводятся из первого и второго начал ТД.
(1)
Первый потенциал внутренняя энергия U.
Пусть нам известна ф-я:
 (2)
(2)
Из (1) следует, что:
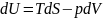 (3)
(3)
 V
(4)
V
(4)
 s
(5)
s
(5)
Внутренняя энергия U в переменных S и V, наз-ся ТД-им потенциалом.
