
- •25. Общее начало термодинамики.
- •6. Понятие температуры. Шкала температур.
- •7. Абсолютная термодинамическая шкала температур.
- •28. Внутренняя энергия системы.
- •9. Работа.
- •30. Теплота.
- •31. Первое начало термодинамики.
- •32. Калорическое и термическое уравнения состояния.
- •33. Теплоемкость.
- •34. Вывод соотношения для .
- •35. Вывод соотношения для в случае идеального газа.
- •36. Основные термодинамические процессы.
- •37. Основные термодинамические процессы для идеального газа.
- •44. Термодинамический потенциал – внутренняя энергия u(s,V).
- •45. Термодинамический потенциал – свободная энергия u(s,V).
- •46. Термодинамический потенциал – потенциал Гиббса u(s,V).
- •47. Термодинамический потенциал – энтальпия u(s,V).
32. Калорическое и термическое уравнения состояния.
Равновесным внутренним параметром ТДС является функция внешних параметров и температуры. Отсюда следует существование уравнений состояния.
Выделяют 2 основных:
Уравнением состояния называют уравнение, связывающее внутренний параметр bк с внешним параметром аi и t.
bк = f (а1, …, an, T) (1)
Если внутренний параметр bк является внутренней энергией, то уравнение состояния U=U(a1,a2,…an, T) (2) называется калорическим состоянием.
Название исходит из того, что через него находят теплоемкость и др. величины измеряемые калориями.
Если внутренний параметр bк является соответствующая внешнему параметру аi обобщённая сила Fi, то уравнение Fi = f (а1, …, an, T) (3) называется термическим уравнением.
Название происходит из того, что с помощью него удаётся выразить температуру.
Общее число калорических и термических состояний равно числу её степеней свободы, то есть числу независимых параметров и функций, характеризующих параметры системы.
Если известно калорическое и термическое состояние, то с помощью начал термодинамики можно определить все термометрические свойства вещества.
Уравнения состояния находятся из опыта или выводятся методами статистической физики.
33. Теплоемкость.
Определяется, как количество теплоты необходимое для изменения температуры системы на 1К°.
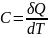 (1)
(1)
Сама теплоемкость зависит от характеристики подвода тепла.
Теплоёмкость показывает какое кол-во теплоты необходимо передать системе, чтобы повысить её температуру на 1°.
Рассмотрим простую ТДС, у которой 1 внешний параметр а, внешняя сила F, Т, заданы калорическое и термическое уравнения.
δA = F*da
F = δA / da
U = U (a, T) (5)
F = F (a, T) (6)
34. Вывод соотношения для .
В термодинамике важную роль играет определение двух теплоёмкостей:
 – теплоёмкость
при постоянном а
– теплоёмкость
при постоянном а
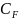 – теплоёмкость
при постоянном F
– теплоёмкость
при постоянном F
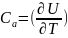 a
(1)
a
(1)
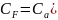 T
T
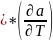 F
(2)
F
(2)
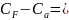 T
+
F
F
(3)
T
+
F
F
(3)
35. Вывод соотношения для в случае идеального газа.
Для определения Сv достаточно знать калорическое состояние. А для Сp – как калорическое, так и термическое состояние.
В термодинамике принимают Са = (δU / δT)а > 0, это означает, что тело с большей теплоёмкостью имеет большую энергию.
Сv > 0
Калорическое состояние выводится из эксперимента.
U = СvT + U0 (1)
 – теплоёмкость
при постоянном объёме
– теплоёмкость
при постоянном объёме
U0 – некоторая const
У одноатомного идеального газа теплоёмкость не зависит от температуры U0 = const.
Термическое уравнение состояния – уравнение Менделеева-Клапейрона.
pV = νRT (2)
ν = m / μ (3)
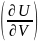 T
= 0;
T
= 0;
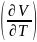 p
=
p
=
 p =
p =
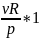
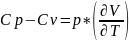 p
=
p
=
 = νR
= νR
 (4)
(4)
Полагая, что ν=1 для 1 моля газа, получаем:
Cp - Cv = R (5)
36. Основные термодинамические процессы.
Рассмотрим случай простой ТДС: а, F, T.
Термодинамический процесс (ТДП) называется переход ТДС из одного ТД равновесного состояния в другое.
Равновесный термодинамический процесс (ТДП) – состояние из последовательных равновесных состояний.
Изменять на бесконечно малую величину параметры системы и ждать наступление ТДРС.
Рассмотрим ТД процессы в этой простой ТДС.
В ней известны 5 РТД процессов:
1. РТД процесс, не производящий теплообмена с окружающей средой δQ = 0 адиабатический;
2. РТД процесс при Т = const изотермический;
3. РТД процесс при постоянной теплоёмкости С = const политропный;
Оставшиеся 2 процесса определяются для частных случаев.
4. РТД процесс при V = const изохорический;
5. РТД процесс при p = const изобарический.
Эти 5 процессов называют основными РТД процессами в термодинамике.
Уравнением процесса называется функциональная связь между любыми 2я параметрами из 3х: Т, а, F.
