
- •Лекции по курсу «Медицинская синергетика»
- •Глава 1
- •1.1 Термодинамическая система, основные понятия и определения
- •1.2 Первый закон термодинамики
- •1.3 Энтальпия. Закон Гесса
- •1.4 Второй закон термодинамики
- •1.5 Термодинамические потенциалы. Максимальная полезная работа
- •1.6 Третий закон термодинамики
1.3 Энтальпия. Закон Гесса
При фиксированном давлении р можно ввести вместо внутренней энергии U новую функцию состояния, которая хорошо описывает термодинамическую систему в этом случае. Так как работа по изменению объема V при постоянном давлении определяется выражением
![]() (1.5)
(1.5)
то первый закон термодинамики можно записать в виде
![]() (1.6)
(1.6)
где введена новая функция состояния - энтальпия (Н)
![]() (1.7)
(1.7)
Энтальпию называют теплосодержанием системы; она важна для изучения химических реакций в живой клетке, протекающих при постоянном давлении. Изменение энтальпии определяется законом Гесса: тепловой эффект химической реакции Q не зависит от пути реакции (от исходных продуктов к продуктам реакции), а определяется лишь разностью энтальпий конечных и исходных веществ
![]()
Закон Гесса прямое следствие первого закона термодинамики. Отметим важное свойство энтальпии: так как изменение теплосодержания системы (энтальпии) соответствует величине поглощенной или выделенной теплоты, то ее можно точно определить с помощью калориметра.
Попытки проверить опытным путем справедливость первого закона термодинамики для биологических объектов предпринимались уже давно. Так, Лавуазье и Лаплас (1780) измеряли в ледяном калориметре количество теплоты и углекислого газа СО2, выделяемых организмом морской свинки, а затем сравнивали полученные величины с тепловым эффектом реакции сжигания исходных продуктов питания до СО2- Эти и последующие измерения показали, что потребление 1л О2 и выделение 1л СО2 при прямом сжигании или окислении в организме продуктов сопровождается выделением 21,2 кДж теплоты. Совпадение тепловых эффектов в обоих случаях свидетельствует о том, что пути превращения продуктов питания в метаболических процессах и химических реакциях вне живой клетки эквивалентны с точки зрения суммарных тепловых эффектов. Иными словами, для процессов метаболизма также справедлив закон Гесса, как и в физической химии. Это дает возможность рассчитать тепловые эффекты сложных биохимических циклов, если известны лишь их начальные и конечные продукты. Прямые эксперименты на людях показали, что количество энергии, поглощенной за сутки человеческим организмом вместе с продуктами питания, равно выделенной за это же время теплоте, что подтверждает справедливость для всех живых организмов первого закона термодинамики. Следовательно, сам по себе живой организм не является независимым источником какой - либо новой формы энергии.
1.4 Второй закон термодинамики
Этот закон устанавливает критерий, отражающий одностороннюю направленность необратимых процессов независимо от их конкретной природы. Согласно второму закону, состояние термодинамической системы может быть описано особой функцией состояния - энтропией S. Изменение энтропии dS определяется суммарным значением поглощенных системой приведенных теплот Q/T. При бесконечно малом изменении состояния системы изменение энтропии dS равно (если процесс равновесный) или больше (если процесс неравновесный) значения поглощенной системой элементарной приведенной теплоты δQ/T
![]() (1.8)
(1.8)
Для системы, которая не обменивается теплом с внешней средой, δQ=0 и уравнение (1.8) принимает вид
![]() (1.9)
(1.9)
Следовательно, в изолированной системе энтропия остается неизменной в равновесных процессах и возрастает в неравновесных. Это и является критерием направленности превращений в изолированной системе. Таким образом, протекающий в изолированной системе самопроизвольный неравновесный процесс всегда вызывает увеличение энтропии до ее максимальных значений при окончании процесса и установлении термодинамического равновесия. Энтропия измеряется в Дж/К или в энтропийных еденицах (э.ед).
В качестве примера приведем абсолютные значения энтропии 1 М воды (Н2О) в различных агрегатных состояниях:
- в твердом состоянии (лед): S = 41кДж/К (9,8э.ед);
- в жидком состоянии: S = 70кДж/К (16,7э.ед);
- в газообразном состоянии (при давлении 1 атм): S = 189кДж/К (45,1э.ед).
Приведенные данные хорошо показывают корреляцию энтропии с неупорядоченностью системы: чем более неупорядоченная система (газообразное состояние), тем больше ее энтропия. Это обстоятельство не является случайным и находит свое объяснение при трактовке энтропии с помощью понятий статистической физики, данной впервые Л. Больцманом. Энтропия, согласно трактовке Больцмана, является мерой неупорядоченности системы. В результате самопроизвольных процессов изолированная система переходит в состояние термодинамического равновесия, которое характеризуется максимальной энтропией (рис.1).
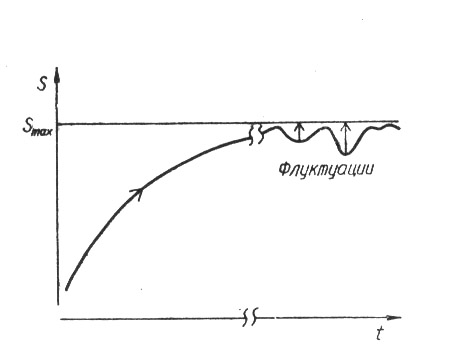
Рис. 1. Изменение энтропии S изолированной системы при достижении состояния термодинамического равновесия.
При равновесии происходят флуктуации, вызывающие локальное уменьшение энтропии dS < 0. Но в системе возникают такие процессы, которые возвращают ее назад в равновесное состояние с максимальной энтропией и максимальной разупо-рядоченностью. Следовательно, стремление энтропии к максимальному значению является главным эволюционным принципом изолированной термодинамической системы.
