
- •Oдноатомные спирты
- •Номенклатура
- •Получение одноатомных спиртов
- •1.Гидратация алкенов
- •2. Гидроксимеркурирование-демеркурирование алкенов
- •3. Гидроборирование алкенов с последующим окислением
- •4. Восстановление альдегидов и кетонов алюмогидридом лития или боргидридом натрия
- •5. Восстановление сложных эфиров и карбоновых кислот до первичных спиртов
- •6. Синтез спиртов из карбонильных соединений с помощью магнийорганических соединений
- •7. Восстановление эпоксидов (оксиранов) с помощью алюмогидрида лития
- •8. Взаимодействие алкилгалогенидов и алкилтозилатов с супероксидом калия
- •III.Свойства одноатомных спиртов
- •1. Спирты как слабые oh-кислоты
- •2. Замещение гидроксильной группы на галоген
- •А. Получение алкилгалогенидов из спирта и галогеноводородов
- •Б. Получение алкилгалогенидов из спиртов и галогенидов фосфора
- •В.Получение алкилхлоридов из спиртов и тионилхлорида
- •Г. Получение алкилгалогенидов из спиртов и квазифосфониевых солей
- •Д. Замещение сульфонатной группы в алкилсульфонатах на галоген
- •3.Дегидратация спиртов
- •4. Получение простых эфиров по Вильямсону
- •5.Окисление спиртов
- •6. Защитные группы для гидроксильной группы
- •Двухатомные спирты
- •I. Получение диолов
- •2. Свойства диолов
- •1.Дегидратация
- •2. Окислительное расщепление 1,2-диолов
- •Простые эфиры номенклатура
- •2.Получение простых эфиров
- •А. Межмолекулярная дегидратация спиртов
- •Б. Алкоксимеркурирование алкенов
- •Синтез простых эфиров по Вильямсону
- •III. Свойства простых эфиров
- •1. Кислотное расщепление простых эфиров
- •2. Радикальные реакции простых эфиров
- •Оксираны (эпоксиды)
- •Получение оксиранов
- •II. Свойства оксиранов
- •Тиолы, сульфиды, сульфоксиды и сульфоны тиолы и сульфиды
- •I. Получение тиолов
- •II. Свойства тиолов
- •1. Фенолы
- •1.1. Введение
- •2. Получение фенолов
- •2.1. Замещение сульфогруппы на гидроксил
- •2.2.Замещение галогена на гидроксил
- •2.3. Замещение диазогруппы на гидроксил
- •2.4. Получение фенола из гидропероксида кумола
- •3. Свойства фенолов
- •3.1. Кислотные свойства фенолов
- •Величины рКа орто-, мета- и пара-замещенных фенолов в воде при 25оС
- •Величины рКа некоторых полизамещенных фенолов и нафтолов
- •3.2. Таутомерия фенолов
- •3.4. Этерификация фенолов
- •3.5. Реакции электрофильного замещения в ароматическом кольце фенола
- •3.5.1. Галогенирование фенолов
- •3.5.2. Нитрование фенолов
- •3.5.3. Сульфирование фенолов
- •3.5.4. Нитрозирование фенолов
- •3.5.5. Алкилирование и ацилирование фенолов по Фриделю-Крафтсу
- •3.5.6. Формилирование фенолов
- •3.5.6А. Реакция Гаттермана
- •3.5.6Б. Реакция Вильсмейера-Хаака
- •3.5.6В. Реакция Реймера-Тимана
- •3.5.7. Конденсация фенолов с альдегидами и кетонами
- •3.5.8. Карбоксилирование феноксид-ионов - реакция Кольбе
- •3.5.9. Азосочетание
- •3.6. Перегруппировка Кляйзена аллилариловых эфиров
- •3.7. Окисление фенолов
- •4. Хиноны
- •4.1. Получение хинонов
- •4.2. Химические свойства хинонов
- •4.2.1.Восстановление хинонов
- •Величины нормальных редокс-потенциалов Ео некоторых хинонов в воде при 25оС
- •4.2.2. Хиноны как дегидрирующие агенты
- •4.2.3. Хиноны как , -непредельные кетоны
- •4.2.4. Хиноны как диенофилы в реакции диенового синтеза
3.4. Этерификация фенолов
Ариловые эфиры карбоновых кислот нельзя получать прямой этерификацией фенолов карбоновыми кислотами. Обратимая реакция фенола с уксусной кислотой эндотермична в отличие от реакции этерификации спиртов, которая экзотермична.
![]()
![]()
Ариловые эфиры карбоновых кислот получают ацилированием фенолов или их Na-, K-солей галогенангидридами или ангидридами кислот.


3.5. Реакции электрофильного замещения в ароматическом кольце фенола
Гидроксильная группа относится к числу групп, активирующих электрофильное замещение в ароматическом кольце и направляющих заместитель в орто- и пара положения. Активирующее влияние гидроксильной группы настолько сильно, что в отдельных случаях реакцию трудно остановить на стадии введения только одного заместителя. Фенолы вступают практически во все типичные реакции электрофильного замещения как с сильными, так и со слабыми электрофильными агентами.
3.5.1. Галогенирование фенолов
Галогенирование фенолов не требует катализа кислотами Льюиса (FeCl3, FeBr3, AlCl3 и др.) и легко осуществляется под действием молекулярного галогена. Галогенирование фенола молекулярным бромом или хлором в полярной среде практически невозможно остановить на стадии моногалогенирования, поскольку реагирующей частицей здесь является фенолят-ион. Фенолят-ион содержит очень сильную активирующую группу - анион кислорода и скорость галогенирования фенолят-иона по крайней мере в тысячу раз выше, чем фенола. Галогензамещенный фенол является более сильной кислотой, чем фенол, он легче диссоциирует, что облегчает введение второго и третьего атома галогена в орто- и пара-положения.

Бромирование фенола в воде приводит к образованию нерастворимого 2,4,6-трибромфенола. Эта реакция настолько чувствительна, что позволяет обнаружить фенол в концентрации 10- 5 М в водном растворе. 2,4,6-трибромфенол взаимодействует еще с одним молем брома с образованием 2,4,4,6-тетрабромциклогекса-2,5-диенона, окрашенного в желтый цвет.

При обработке продукта этой реакции раствором гидросульфита натрия или другого слабого восстановителя он легко превращается в исходный 2,4,6-трибромфенол. Производные циклогексадиенонов могут быть выделены при бромировании 2,6-ди- и 2,4,6-тризамещенных пространственно затрудненных фенолов.


При бромировании фенола в растворе бромистоводородной кислоты или при хлорировании в соляной кислоте диссоциация полностью подавляется и галогенированию подвергается сам фенол. При этом в зависимости от условий и количества галогена может быть получен п-бромфенол или 2,4-дибромфенол.


Аналогичным образом протекает и хлорирование фенола, но здесь получается значительное количество о-хлорфенола. Моногалогензамещенные производные фенолов удобно получать при галогенировании в неполярной среде, что также исключает диссоциацию фенолов.
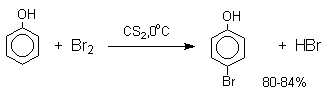

В качестве галогенирующего агента кроме самих галогенов можно использовать комплексы галогенов с диоксаном, ДМФА.

Во всех случаях соотношение пара/орто-изомеров при бромировании и иодировании значительно выше, чем при хлорировании.
