
БИЛЕТ №1
1. Всасывание аминокислот
Всасывание аминокислот в кишечнике
Всасывание L-аминокислот (но не D-) — это активный процесс, в результате которого аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь.
Известно пять специфических транспортных систем, каждая из которых функционирует для переноса определённой группы близких по строению аминокислот:
1) нейтральных, короткой боковой цепью (аланин, серии, треонин);
2) нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолейцин);
3) с катионными радикалами (лизин, аргинин);
4) с анионными радикалами (глутаминовая и аспарагиновая кислоты);
5) иминокислот (пролин, оксипролин).
Механизм переноса аминокислот в эпителиальные клетки кишечника
Существуют 2 основных механизма переноса аминокислот: 1) симпорт с натрием и 2) γ-глутамильный цикл.
1. Симпорт аминокислот с Na+.
Симпортом с Nа+ переносятся аминокислоты из первой и пятой группы, а также метионин.
L-аминокислота поступает в энтероцит путём симпорта с ионом Na+. Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первично-активного транспорта с помощью Na+,К+-АТФ-азы. Таким образом, для такого переноса аминокислот используется энергия электрохимического потенциала ионов натрия, запасённая им в процессе выдворения его из клетки натрий-калиевым насосом (Na+,К+-АТФ-азой) против градиента концентрации. Энтероциты в этом используют тот же механизм, что и нейроны при формировании потенциала покоя.
2. γ-Глутамильный цикл.
Более изощрённый по сравнению с симпортом γ-глутамильный цикл переносит некоторые нейтральные аминокислоты (фенилаланин, лейцин) и аминокислоты с катионными радикалами (лизин) в кишечнике, почках и, по-видимому, мозге.
Рис. 2.
В этой системе участвуют 6 ферментов, один из которых находится в клеточной мембране, а остальные — в цитозоле. Мембранно-связанный фермент γ-глутамилтрансфераза (гликопротеин) катализирует перенос γ-глутамильной группы от глутатиона на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Аминокислота отщепляется от у-глутамильного остатка под действием фермента у-глутамилциклотрансферазы.
Дипептид цистеинилглицин расщепляется под действием пептидазы на 2 аминокислоты — цистеин и глицин. В результате этих 3-х реакций происходит перенос одной молекулы аминокислоты в клетку (или внутриклеточную структуру). Следующие 3 реакции обеспечивают регенерацию глутатиона, благодаря чему цикл повторяется многократно. Для транспорта в клетку одной молекулы аминокислоты с участием у-глутамильного цикла затрачиваются 3 молекулы АТФ. Важно отметить эти заметные потери энергии, затраченной на всасывание аминокислот при белковом питании.
Поступление аминокислот в организм осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30—50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Аминокислоты при всасывании конкурируют друг с другом за специфические участки связывания. Например, всасывание лейцина (если концентрация его достаточно высока) уменьшает всасывание изолейцина и валина.
1.Выраженным нарушением потребления белков является квашиоркор – нехватка белков, особенно животных, в пище. В результате возникает дисбаланс аминокислотного состава пищи и недостаток незаменимых аминокислот. Заболевание наиболее характерно для слаборавитых
стран Азии и Африки и его начало совпадает с отнятием ребенка от груди матери (1,5-3 годика), когда он лишается полноценного белка и переходит на скудное растительное питание взрослых. У больных наблюдается истощение, остановка роста, отечность, анемия, нарушение интеллекта и памяти, умственная отсталость, гипопротеинемия и аминоацидурия.
2.Целиакия – наследственное прогрессирующее заболевание, приводящее к изменениям в тощей кишке: воспалению и сглаживанию слизистой оболочки, исчезновению ворсинок, атрофии щеточной каемки и появлению кубовидных энтероцитов. Причиной является врожденная непереносимость белка клейковины злаков глютена, или точнее – его растворимой фракции глиадина. Заболевание проявляется после введения в рацион младенца глиадин содержащих продуктов, в первую очередь манной каши. Патогенез заболевания до сих пор не выяснен, имеются гипотеза о прямом токсическом воздействии на стенку кишечника и гипотеза иммунного ответа на белок в стенке кишки.
3.В печени происходит обезвреживание токсических веществ, поступающих из толстого кишечника, с помощью двух систем:
o система микросомального окисления,
o система конъюгации.
Цель и суть работы систем обезвреживания заключается в маскировке токсичных групп (например, в феноле токсична ОН-группа) и/или в придании гидрофильности молекуле, что способствует ее выведению с мочой и отсутствию накопления в нервной и жировой ткани.
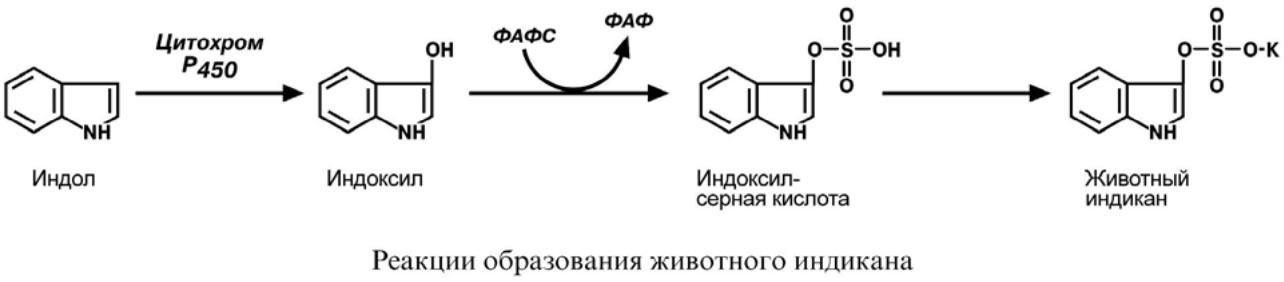
4. О Б Р А З О В А Н И Е Ж И В О Т Н О Г О И Н Д И К А Н А
Примером реакций обезвреживания веществ является превращение индола в животный индикан. Сначала индол окисляется с участием цитохрома Р450 до индоксила, затем конъюгирует с серной кислотой с образованием индоксилсульфата и далее калиевой соли – животного индикана.
При повышенном поступлении индола из толстого кишечника образование индикана в печени усиливается, далее он поступает в почки и выводится с мочой. По концентрации животного индикана в моче можно судить об интенсивности процессов гниения белка в кишечнике.
 2.
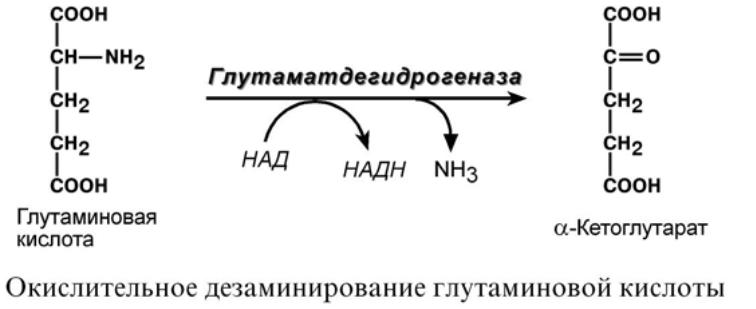
Аспарагиновая кислота (после реакции
трансаминирования) и глутаминовая
кислота
2.
Аспарагиновая кислота (после реакции
трансаминирования) и глутаминовая
кислота
(после дезаминирования) превращаются в метаболиты ЦТК, соответственно, в оксалоацетат
и α-кетоглутарат.
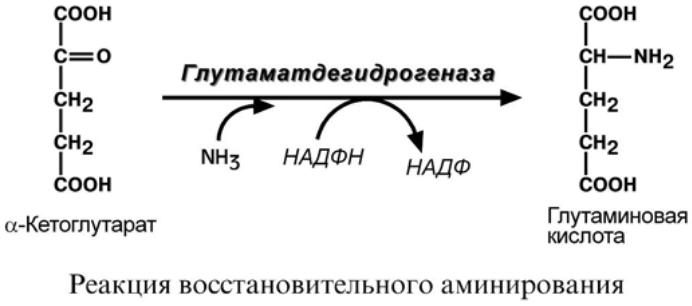
синтез глутаминовой кислоты (восстановительное аминирование) – реакция по сути
обратна реакции окислительного дезаминирования, однако в качестве кофермента ис-
пользуется НАДФН. Происходит практически во всех тканях, кроме мышечной, но
имеет небольшое значение, т.к. для глутаматдегидрогеназы предпочтительным суб-
стратом является глутаминовая кислота и равновесие реакции сдвинуто в сторону
α-кетоглутарата
2. Система дикарбоновых аминокислот, к которой относят также соответствующие α-кетокислоты, теснейшим образом связана не только с азотистым метаболизмом в целом, но и с обменом липидов и углеводов. Ранее отмечалась особая роль дикарбоновых аминокислот и ферментов, катализирующих их превращения, в перераспределении азота в организме, дезаминировании и синтезе природных аминокислот (реакции трансде-заминирования и трансреаминирования), в образовании конечных продуктов белкового обмена – синтезе мочевины. Аспарагиновая кислота принимает непосредственное участие в орни-тиновом цикле мочевинообразования, в реакциях трансаминирования и биосинтезе углеводов (гликогенная аминокислота), карнозина и ансерина, пуриновых и пиримидиновых нуклеотидов (см. главу 14), а также в синтезе N-ацетиласпарагиновой кислоты в ткани мозга. Роль последней, содержащейся в довольно высоких концентрациях в ткани мозга млекопитающих, пока не выяснена.
Глутаминовая кислота, являющаяся гликогенной и заменимой аминокислотой для человека и животных, также включается в синтез ряда специфических метаболитов, в частности глутатиона и глутамина. Помимо участия в транспорте аммиака и регуляции кислотно-щелочного равновесия, глутамин – это незаменимый источник азота в ряде синтезов, в частности в биосинтезе пуриновых и пиримидиновых нуклеотидов, амино-сахаров, в обезвреживании фенилуксусной кислоты (синтез фенилацетил-глутамина) у человека и человекообразных обезьян, а также в синтезе витамина фолиевой кислоты (птероилглутаминовая кислота). На рис. 12.8 суммированы реакции синтеза ряда веществ, в которых амидный азот глутамина выполняет специфическую роль, незаменимую азотом других аминокислот.
Глутамин и аспарагин оказались, кроме того, эссенциальными факторами для роста некоторых нормальных и опухолевых клеток в культуре ткани; они не могут быть заменены ни друг другом, ни соответствующими дикарбоновыми аминокислотами. Это свидетельствует о том, что в условиях выращивания клеток в культуре ткани некоторые клетки теряют способность синтезировать эти амиды синтетазным или трансаминазным путем.
3.
1.Генетический (биологический) код – это способ перевода четырехзначного (А, Г, У, Ц)языка нуклеотидов в двадцатизначный язык аминокислотной последовательности.
Свойства биологического кода
Триплетность – три нуклеотида формируют кодон, кодирующий аминокислоту. Всего насчитывают 61 смысловой кодон.
Специфичность (или однозначность) – каждому кодону соответствует только одна аминокислота.
Вырожденность – одной аминокислоте может соответствовать несколько кодонов.
Универсальность – биологический код одинаков для всех видов организмов на Земле(однако в митохондриях млекопитающих есть исключения).
Колинеарность – последовательность кодонов соответствует последовательности аминокислот в кодируемом белке.
Неперекрываемость – триплеты не накладываются друг на друга, располагаясь рядом.
Отсутствие знаков препинания – между триплетами нет дополнительных нуклеоти дов или каких-либо иных сигналов.
Однонаправленность – при синтезе белка считывание кодонов идет последовательно,без пропусков или возвратов назад.
2.Адапторная роль тРнк
Транспортные РНК являются единственным посредником между 4-х буквенной последовательностью нуклеиновых кислот и 20-ти буквенной последовательностью белков. Именно от наличия того или иного антикодона в тРНК зависит, какая аминокислота включится в
белковую молекулу, т.к. ни рибосома, ни мРНК не узнают аминокислоту. Таким образом,адапторная роль тРНК заключается: 1) в специфичном связывании с аминокислотами, 2) во
включении аминокислот в белковую цепь в соответствии с матрицей мРНК.
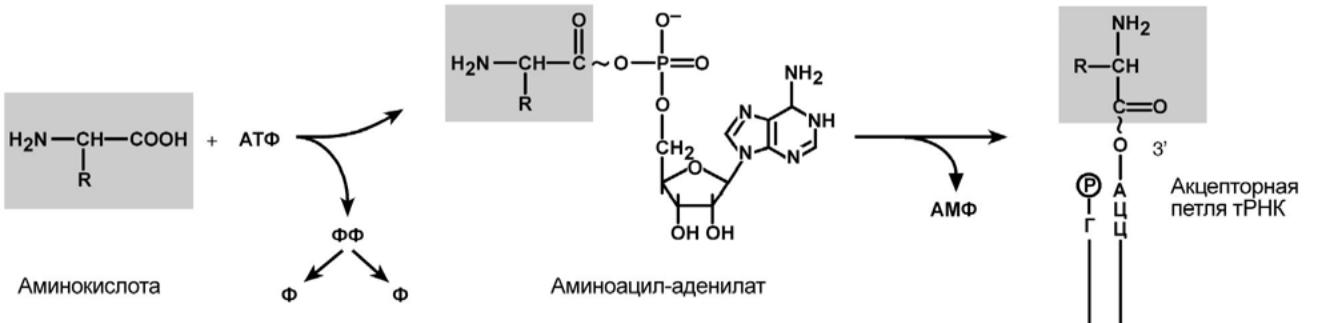
Специфичное присоединение аминокислоты к тРНК осуществляется ферментом аминоацил-тРНК-синтетазой, имеющей специфичность одновременно к двум соединениям:
какой-либо аминокислоте и соответствующей ей тРНК. Для реакции требуется две макроэргические связи АТФ. Аминокислота присоединяется к 3'-концу акцепторной петли тРНК через α-карбоксильную группу, и связь между аминокислотой и тРНК становится макроэргической. α-Аминогруппа остается свободной.
Так как существует около 60 различных тРНК, то некоторым аминокислотам соответствует по две или более тРНК. Различные тРНК, присоединяющие одну аминокислоту, назы-
вают изоакцепторными.
4.

Билет №2
1.
1. СОЛЯНАЯ КИСЛОТА
Одним из компонентов желудочного сока является соляная кислота. В образовании
соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, обра-
зующие ионы Н+ и переносящие ионы Сl– из крови в полость желудка.
Источником ионов Н+ является угольная кислота, образуемая ферментом карбоангид-
разой. При ее диссоциациии, кроме ионов водорода, образуются карбонат-ионы НСО3
–. Они
по градиенту концентрации движутся в кровь в обмен на ионы Сl–. В полость желудка ионы
Н+ попадают энергозависимым антипортом с ионами К+ (Н+,К+-АТФаза), хлорид-ионы пере-
качиваются в просвет желудка также с затратой энергии.
При нарушении нормальной секреции HCl возникают гипоацидный или гиперацид-
ный гастрит, отличающиеся друг от друга по клиническим проявлениям и требуемой схеме
лечения.
Функции соляной кислоты
o денатурация белков пищи,
o бактерицидное действие,
o высвобождение железа из комплекса с белками и перевод его в двухвалентную фор-
му, что необходимо для его всасывания,
o превращение неактивного пепсиногена в активный пепсин,
o снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для рабо-
ты пепсина.
2.остальное в практикуме его у меня нет
2. Образованный в реакции распада серина до глицина N5,N10-метилен-ТГФК при уча-
стии фермента метилен-ТГФК-редуктазы превращается в N5-метил-ТГФК. Она участвует в
метионин-синтазной реакции реметилирования гомоцистеина в метионин.
Метионин впоследствии присоединяет аденозильный остаток и превращается в актив-
ную форму метионина – S-аденозилметионин, участвующий во многих реакциях метилиро-
вания, в частности, при синтезе креатина, фосфатидилхолина, адреналина. В результате пе-
ремещения метильной группы и отщепления аденозина остается гомоцистеин, имеющий два
пути метаболизма. Первый путь – реметилирование до метионина и вновь участие в реакци-
ях метилирования. Второй путь – взаимодействие с серином при участии цистатионин-
синтазы,
превращение в цистатионин с последующим
распадом в цистеин и гомосерин.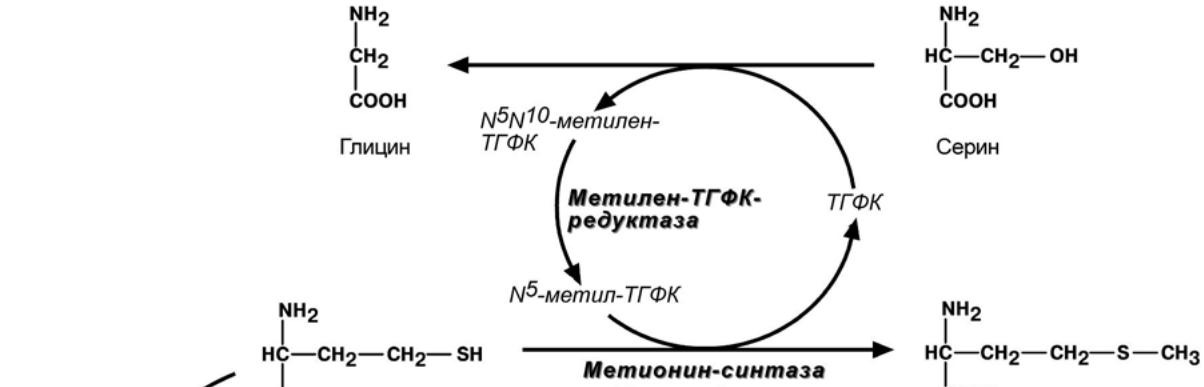
 ГОМОЦИСТЕИНЕМИЯ
ГОМОЦИСТЕИНЕМИЯ
В настоящее время самым актуальным нарушением является гомоцистеинемия – на-
копление гомоцистеина в крови.
Причины. Все причины данного нарушения делят, как минимум, на две группы:
