
- •1. Ферменти: визначення; властивості ферментів як біологічних каталізаторів.
- •2. Класифікація та номенклатура ферментів, характеристика окремих класів
- •3. Будова та механізми дії ферментів. Активний та алостеричний (регуляторний) центр.
- •7. Механізми дії та кінетика ферментативних реакцій: залежність швидкості
- •10. Типи інгібування ферментів: зворотнє (конкурентне, неконкурентне) та
- •11. Регуляція ферментативних процесів. Шляхи та механізми регуляції:
- •14. Ензимодіагностика патологічних процесів та захворювань.
- •15. Ензимотерапія – застосування ферментів, їх активаторів та інгібіторів в
- •16. Принципи та методи виявлення ферментів у біооб’єктах. Одиниці виміру
- •Біохімія водо – та жиророзчинних вітамінів
- •2. Вітамін в2: структура, коферментна форма, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •3. Метаболізм вуглеводів та його регуляція.
- •4. Вітамін в3: структура, кофермента форма, біологічні властивості, механізм
- •5. Вітамін в5: структура, коферментна форма, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •6. Вітамін в6: структура, коферментна форма, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •7. Вітамін в12: будова, біологічні властивості, механізм дії, джерела, добова
- •8. Вітамін с: будова, біологічні властивості, механізм дії, джерела, добова
- •9. Вітамін н: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •10. Вітамін р: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •13. Вітамін д: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •14. Вітамін к: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •Біохімія механізму дії гормонів
- •Основні закономірності обміну речовин. Цикл трикарбонових кислот.
- •1. Обмін речовин (метаболізм) – загальні закономірності протікання катоболічних та анаболічних процесів.
- •5. Субстратне фосфорилювання цтк.
- •Молекулярні основи біоенергетики.
- •1. Реакції біологічного окислення; типи реакцій (дегідрогеназні, оксидазні, оксигеназні) та їх біологічне значення. Тканинне дирхання.
- •2. Флавінзалежні дегідрогенази
- •3. Послідовність компонентів дихального ланцюга мітохондрій. Молекулярні
- •4. Окисне фосфорилювання: пункти спряження транспорту електронів та фосфорилювання, коефіцієнт окисного фосфорилювання.
- •Пункти спряження транспорту електронів та окисного фосфорилювання
- •Ділянки дихального ланцюга мітохондрій, де вивільнення хімічної енергії достатнє для синтезу молекули атф
- •7. Мікросомальне окислення: цитохром р-450; молекулярна організація ланцюга переносу електронів.
- •Обмін вуглеводів
- •3. Аеробне окислення глюкози. Етапи репетворення глюкози до co2 , h2o.
- •4. Окислювальне декарбоксилювання пірувату. Ферменти, коферменти та послідовність реакцій в мультиферментному комплексі.
- •5. Гліколітична оксидоредукція : субстратне фосфорилювання та човникові
- •6. Порівняльна характеристика біоенергетики аеробного та анаеробного окислення глюкози, ефект Пастера.
- •7. Фосфоролітичний шлях розщеплення глікогену в печінці та мязах.
- •8. Біосинтез глікогену: ферментативні реакції, фізіологічне значення.
- •9. Механізми реципрокної регуляції глікогенолізу та глікогенезу за рахунок
- •10. Роль адреналіну, глюкагону та інсуліну в гормональній регуляції обміну
- •11. Генетичні порушення метаболізму глікогену (глікогенози, аглікогенози).
- •12. Глюконеогенез: субстрати , ферменти та фізіологічне значення процесу.
- •13. Глюкозо-лактатний (цикл Корі) та глюкозо-аланіновий цикли.
- •Метаболізм амінокислот. Ензимопатії амінокислотного обміну
- •Амінотрансферазні реакції
- •Окислення біогенних амінів
- •5. Шляхи утворення та знешкодження аміаку в організмі.
- •Генетичні дефекти ферментів синтезу сечовини
- •12. Обмін циклічної амінокислоти триптофану та його спадкові ензимопатії.
Окислення біогенних амінів
Накопичення біогенних амінів в організмі спричиняє несприятливі патофізіологічні
зміни з боку серцево-судинної системи, кишечника, інших гладком’язових органів.
Знешкодження (детоксикація) фізіологічно активних амінів відбувається в клітинах
печінки
за участі моноамінооксидази мітохондрій
- ФАД-залежного ферменту, що
спричиняє
окислювальне дезамінування амінів до
альдегідів:![]()
Альдегіди - продукти дезамінування біогенних амінів - окислюються до відповідних
кислот і підлягають подальшій окислювальній деградації або екскретуються з організму із сечею. Аміак надходить у систему синтезу сечовини.
5. Шляхи утворення та знешкодження аміаку в організмі.
Головним у кількісному відношенні джерелом наконичення аміаку в організмі людини є окислювальне дезамінування амінокислот.
Додатковими джерелами ендогенного аміаку є реакції дезамінування біогенних амінів, азотистих основ, які утворюються при катаболізмі нуклеотидів. Значна кількість вільного аміаку всмоктується в кров із системи ворітної вени (v. porta) внаслідок його утворення при катаболізмі азотовмісних біоорганічних сполук (головним чином, білків продуктів харчування) кишковими бактеріями.
Основним джерелом утворення аміаку в тканині головного мозку є реакція гідролітичного дезамінування АМФ до інозинмонофосфату (ІМФ), що каталізується ферментом аденозиндезаміназою:
АМФ+H2O --- ІМФ+NH3
Аміак, що вивільняється, знешкоджується в результаті глуглутамінсинтетазної реакції, утворюючи з L-глутамату глутамін, який виводиться з головного мозку.
Механізми знешкодження аміаку:
1. виведення у вигляді розчинного іону амонію.
2.виведення у вигляді сечової кислоти.
3. основний продукт знешкодження та екскретуквання аміаку- утв сечовини.
6. Біосинтез сечовини: послідовність ферментних реакцій біосинтезу, генетичні
аномалії ферментів циклу сечовини.
Синтез відбув з аміаку та вугільної кислоти в результ. циклічного процесу, в якому каталітичну роль грають а-кти аргінін, орнітин та цитрулін.
Джерелами двох аміногруп, що використ. для утв молекули сечовини, є аміак, що вивільняється при окислювальному дезамінуванні L-глутамату, та аміногрупа кислоти L-аспартату.
Ферментні реакції:
1. Утворення з аміаку та дюксиду вуглецю за участю АТФ карбамоїлфосфату:
Реакція
каталізується карбамоїлфосфатсинтетазою.
Джерелом аміногрупи (у вигляді молекули
аміаку) с глутаматдегідрогсназна
реакція.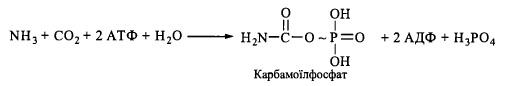

2. Перенесення карбамоїльної групи на орнітин з утворенням цитруліну (фермент -
орнітинкарбамоїлтрансфераза):
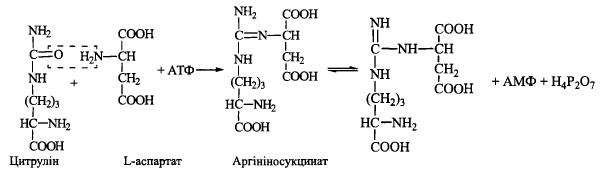
3. Акцептування другої аміногрупи шляхом взаємодії цитруліну з L-аспартатом
(фермент - аргініносукцинатсинтетаза):
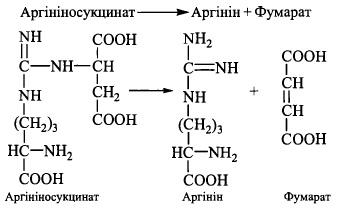
4. Розщеплення аргініносукцинату при дії ферменту аргініносукцинатліази; продуктами реакції є: аргінін - безпосередній попередник сечовини - та фумарат:
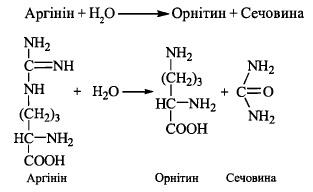
5. Гідроліз аргініну при дії ферменту аргінази з утворенням сечовини та регенерацією орнітину (завершення метаболічного циклу):
