
- •1. Ферменти: визначення; властивості ферментів як біологічних каталізаторів.
- •2. Класифікація та номенклатура ферментів, характеристика окремих класів
- •3. Будова та механізми дії ферментів. Активний та алостеричний (регуляторний) центр.
- •7. Механізми дії та кінетика ферментативних реакцій: залежність швидкості
- •10. Типи інгібування ферментів: зворотнє (конкурентне, неконкурентне) та
- •11. Регуляція ферментативних процесів. Шляхи та механізми регуляції:
- •14. Ензимодіагностика патологічних процесів та захворювань.
- •15. Ензимотерапія – застосування ферментів, їх активаторів та інгібіторів в
- •16. Принципи та методи виявлення ферментів у біооб’єктах. Одиниці виміру
- •Біохімія водо – та жиророзчинних вітамінів
- •2. Вітамін в2: структура, коферментна форма, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •3. Метаболізм вуглеводів та його регуляція.
- •4. Вітамін в3: структура, кофермента форма, біологічні властивості, механізм
- •5. Вітамін в5: структура, коферментна форма, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •6. Вітамін в6: структура, коферментна форма, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •7. Вітамін в12: будова, біологічні властивості, механізм дії, джерела, добова
- •8. Вітамін с: будова, біологічні властивості, механізм дії, джерела, добова
- •9. Вітамін н: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •10. Вітамін р: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •13. Вітамін д: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •14. Вітамін к: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •Біохімія механізму дії гормонів
- •Основні закономірності обміну речовин. Цикл трикарбонових кислот.
- •1. Обмін речовин (метаболізм) – загальні закономірності протікання катоболічних та анаболічних процесів.
- •5. Субстратне фосфорилювання цтк.
- •Молекулярні основи біоенергетики.
- •1. Реакції біологічного окислення; типи реакцій (дегідрогеназні, оксидазні, оксигеназні) та їх біологічне значення. Тканинне дирхання.
- •2. Флавінзалежні дегідрогенази
- •3. Послідовність компонентів дихального ланцюга мітохондрій. Молекулярні
- •4. Окисне фосфорилювання: пункти спряження транспорту електронів та фосфорилювання, коефіцієнт окисного фосфорилювання.
- •Пункти спряження транспорту електронів та окисного фосфорилювання
- •Ділянки дихального ланцюга мітохондрій, де вивільнення хімічної енергії достатнє для синтезу молекули атф
- •7. Мікросомальне окислення: цитохром р-450; молекулярна організація ланцюга переносу електронів.
- •Обмін вуглеводів
- •3. Аеробне окислення глюкози. Етапи репетворення глюкози до co2 , h2o.
- •4. Окислювальне декарбоксилювання пірувату. Ферменти, коферменти та послідовність реакцій в мультиферментному комплексі.
- •5. Гліколітична оксидоредукція : субстратне фосфорилювання та човникові
- •6. Порівняльна характеристика біоенергетики аеробного та анаеробного окислення глюкози, ефект Пастера.
- •7. Фосфоролітичний шлях розщеплення глікогену в печінці та мязах.
- •8. Біосинтез глікогену: ферментативні реакції, фізіологічне значення.
- •9. Механізми реципрокної регуляції глікогенолізу та глікогенезу за рахунок
- •10. Роль адреналіну, глюкагону та інсуліну в гормональній регуляції обміну
- •11. Генетичні порушення метаболізму глікогену (глікогенози, аглікогенози).
- •12. Глюконеогенез: субстрати , ферменти та фізіологічне значення процесу.
- •13. Глюкозо-лактатний (цикл Корі) та глюкозо-аланіновий цикли.
- •Метаболізм амінокислот. Ензимопатії амінокислотного обміну
- •Амінотрансферазні реакції
- •Окислення біогенних амінів
- •5. Шляхи утворення та знешкодження аміаку в організмі.
- •Генетичні дефекти ферментів синтезу сечовини
- •12. Обмін циклічної амінокислоти триптофану та його спадкові ензимопатії.
Метаболізм амінокислот. Ензимопатії амінокислотного обміну
1. Пул вільних амінокислот в організмі: шляхи надходження та використання вільних амінокислот в тканинах.
Амінокислоти - органічні сполуки, які одночасно містять у своєму складі аміно- (- NH2) та карбоксильну (- СООН) групи. Амінокислоти є мономерними одиницями білків, у складі яких залишки амінокислот з'єднані пептидними зв'язками.
Пул – постійний фонд вільних амінокислот.
Потік а-кт що входять до пулу скл з таких джерел:
1. А-кт,які всмоктуються ентероцитами кишечника внаслідок гідролізу харчових білків у травному каналі.
2. А-кт, які вивільняються внаслідок розщеплення власних клітинних і позаклітинних білків. Розщеплення тканинних білків каталізується протеазами лізосом і збільшується за умов часткового і повного голодування, під час хвороб. Які порушують процеси біосинтезу білків, і спричиняють переважання катаболічних процесів над анаболічними.
3. А-кт, які синтезуються в організмі. Ферментні системи організму здатні синтезувати з інших інтермедіатів в кількості, достатній для синтезу лише 8 L-а-кт.
Замінні: аланін, аспаргінова кислота, аспарагін,глутамінова кислота, глутамін,пролін, гліцин, серин.
При їх біосинтезі вуглецева частина утворюється з інтермедіатів окислення глюкози та цтк, а аміногрупа постачається з інших кислот у реакції трансамінування.
Потік а-кт, що виходять з пулу скл з таких компонентів:
1. Використання а-кт для синтезу білків організму. Цей потік забезпечує покриття протеолізу власних білків – стан азотистої рівноваги.
2.
Використання а-кт,які не включені в
анаболічні процеси, в катаболічних
реакціях. При цьому молекули а-кт
розщеплюються з утворенням діоксиду
вуглецю, води (через цтк), та кінцевих
продуктів азотистого обміну (переважно
сечовини).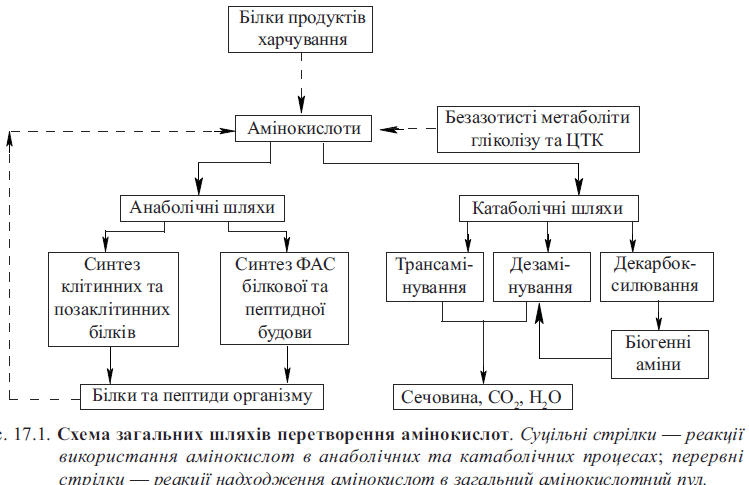
2.
Трансамінування амінокислот: реакції
та їх біохімічне значення, механізм дії
амінотрансфераз.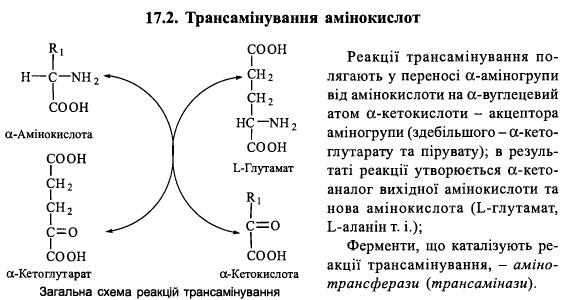
Амінотрансферазні реакції
Амінотрансферази – складні білки-ферменти, простетичною групою в яких є коферментні форми вітаміну В6 – ПАЛФ,ПАМФ.
Найбільш поширеними є такі амінотрансферази:
1) аланінамінотрансфераза (глутамат-піруваттрансаміназа - ГПТ):
L-аланін + а-кетоглутарат = Піруват + L-глутамат
2) аспартатамінотрансфераза (глутамат-оксалоацетаттрансаміназа - ГОТ):
L-аспартат + а-кетоглутарат = Оксалоацетат + L-глутамат
3) тирозинамінотрансфераза:
L-тирозин + а-кетоглутарат = р-гідроксифенілпіруват + L-глутамат
4) лейцинамінотрансфераза:
L-лейцин + а-кетоглутарат = а-кетоізокапроат + L-глутамат
Реакції – в печінці, скелетних мязах, міокарді, мозку. нирках.
Внаслідок виходу ферментних білків Аст і АлТ через мембрани пошкоджених клітин в кров при інфаркті міокарда – підвищення активності АсТ, при вірусних чи токсичних пошкодженнях печінки – АлТ.
Механізм дії:
Надходження вітаміну В6 утворення його коферменту шляхом фосфорилювання піридоксолу до ПОЛФ за дії АТФ-залежної кінази окислення ПОЛФ до ПАЛФ.
У ферменті амінотрансферази кофермент ПАЛФ сполучений з поліпептидним ланцюгом.
У
процесі трансамінування відбувається
циклічне перетв ПАЛФПАМФ.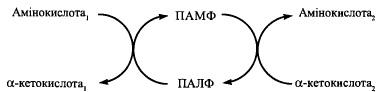
Процес скл з 2 реакцій:
1. а-кта1 + ПАЛФ-Е α-кетокислота1 + ПАМФ-Е
2. α-кетокислота2 + ПАМФ-Е а-кта2 + ПАЛФ-Е
Значення реакцій трансамінування:
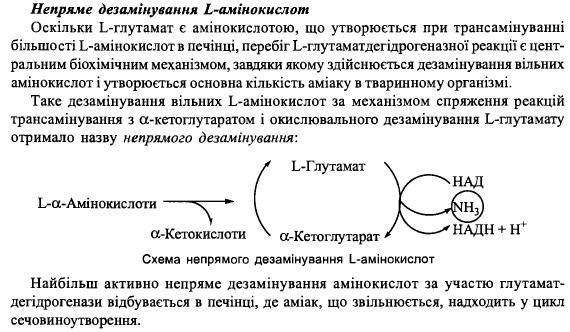
У печінці – колекторна ф-я, тобто збирання аміногруп від різних а-кт у вигляді L-глутамінової кислоти.
Він є основним субстратом для реакцій дезамінування, тобто постачальником аміногруп для утв сечовини.
У мязах – утворюється аланін що виділ в кров і поглинається гепатоцитами. В печінці аланін знов перетв на пвк, який використовується в глюконеогенезі.
3. Дезамінування вільних L-амінокислот в тканинах.
4. Декарбоксилювання L-амінокислот в організмі людини. Фізіологічне значення
утворених
продуктів. Окислення біогенних амінів.
Реакція дскарбоксилювання амінокислот полягає у відщепленні діоксиду вуглецю від молекули амінокислоти з утворенням амінів (біогенних амінів), значна частина яких має високу фізіологічну активність як гормони, нейромедіатори, або є їх попередниками чи метаболітами:
Реакція каталізується ферментами - декарбоксилазами амінокислот, коферментом яких є піридоксальфосфат. Декарбоксилази амінокислот є стереоспецифічними ферментами, що діють тільки на L-стереоізомери. Прикладами реакцій декарбоксилування амінокислот у кишечнику є утворення токсичних діамінів, т.з. птомаїнів (“трупних отрут”) з діаміномонокарбонових кислот орнітину та путресцину.
