
- •1. Ферменти: визначення; властивості ферментів як біологічних каталізаторів.
- •2. Класифікація та номенклатура ферментів, характеристика окремих класів
- •3. Будова та механізми дії ферментів. Активний та алостеричний (регуляторний) центр.
- •7. Механізми дії та кінетика ферментативних реакцій: залежність швидкості
- •10. Типи інгібування ферментів: зворотнє (конкурентне, неконкурентне) та
- •11. Регуляція ферментативних процесів. Шляхи та механізми регуляції:
- •14. Ензимодіагностика патологічних процесів та захворювань.
- •15. Ензимотерапія – застосування ферментів, їх активаторів та інгібіторів в
- •16. Принципи та методи виявлення ферментів у біооб’єктах. Одиниці виміру
- •Біохімія водо – та жиророзчинних вітамінів
- •2. Вітамін в2: структура, коферментна форма, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •3. Метаболізм вуглеводів та його регуляція.
- •4. Вітамін в3: структура, кофермента форма, біологічні властивості, механізм
- •5. Вітамін в5: структура, коферментна форма, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •6. Вітамін в6: структура, коферментна форма, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •7. Вітамін в12: будова, біологічні властивості, механізм дії, джерела, добова
- •8. Вітамін с: будова, біологічні властивості, механізм дії, джерела, добова
- •9. Вітамін н: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •10. Вітамін р: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •13. Вітамін д: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •14. Вітамін к: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •Біохімія механізму дії гормонів
- •Основні закономірності обміну речовин. Цикл трикарбонових кислот.
- •1. Обмін речовин (метаболізм) – загальні закономірності протікання катоболічних та анаболічних процесів.
- •5. Субстратне фосфорилювання цтк.
- •Молекулярні основи біоенергетики.
- •1. Реакції біологічного окислення; типи реакцій (дегідрогеназні, оксидазні, оксигеназні) та їх біологічне значення. Тканинне дирхання.
- •2. Флавінзалежні дегідрогенази
- •3. Послідовність компонентів дихального ланцюга мітохондрій. Молекулярні
- •4. Окисне фосфорилювання: пункти спряження транспорту електронів та фосфорилювання, коефіцієнт окисного фосфорилювання.
- •Пункти спряження транспорту електронів та окисного фосфорилювання
- •Ділянки дихального ланцюга мітохондрій, де вивільнення хімічної енергії достатнє для синтезу молекули атф
- •7. Мікросомальне окислення: цитохром р-450; молекулярна організація ланцюга переносу електронів.
- •Обмін вуглеводів
- •3. Аеробне окислення глюкози. Етапи репетворення глюкози до co2 , h2o.
- •4. Окислювальне декарбоксилювання пірувату. Ферменти, коферменти та послідовність реакцій в мультиферментному комплексі.
- •5. Гліколітична оксидоредукція : субстратне фосфорилювання та човникові
- •6. Порівняльна характеристика біоенергетики аеробного та анаеробного окислення глюкози, ефект Пастера.
- •7. Фосфоролітичний шлях розщеплення глікогену в печінці та мязах.
- •8. Біосинтез глікогену: ферментативні реакції, фізіологічне значення.
- •9. Механізми реципрокної регуляції глікогенолізу та глікогенезу за рахунок
- •10. Роль адреналіну, глюкагону та інсуліну в гормональній регуляції обміну
- •11. Генетичні порушення метаболізму глікогену (глікогенози, аглікогенози).
- •12. Глюконеогенез: субстрати , ферменти та фізіологічне значення процесу.
- •13. Глюкозо-лактатний (цикл Корі) та глюкозо-аланіновий цикли.
- •Метаболізм амінокислот. Ензимопатії амінокислотного обміну
- •Амінотрансферазні реакції
- •Окислення біогенних амінів
- •5. Шляхи утворення та знешкодження аміаку в організмі.
- •Генетичні дефекти ферментів синтезу сечовини
- •12. Обмін циклічної амінокислоти триптофану та його спадкові ензимопатії.
Питання до контрольної роботи з біологічної хімії
«Загальні закономірності метаболізму»
Ферменти та коферменти. Регуляція метаболізму.
1. Ферменти: визначення; властивості ферментів як біологічних каталізаторів.
Ферменти – це біологічні каталізатори білкової природи,які синтезуються в клітинах живих організмів і забезпечують необхідні швидкість і координацію бх реакцій, що становлять обмін речовин (метаболізм).
Властивості:
-
Підвищують швидкість перебігу як прямої, так і зворотньої реакції перетворення субстрату, не змінюючи константи рівноваги та зменшуючи термін часу.
-
Протягом реакції, фермент певним чином взаємодіє з субстратом,що перетворюється, але до складу кінцевих продуктів реакції не входить. Під час перебігу реакції фермент регенерується.
-
Є високоспецифічними каталізаторами. Діють лише на структурно близькі субстрати. Здатні перетворювати лише Л-моносахариди/амінок-ти або лише Д-моносах./а-кти.
-
Каталітична активність чутлива до змін фіз-хім властивостей середовища,які мможуть впливати на структурну організацію молекул, спричиняючи їх денатурацію.
-
Активність ферментів і швидкість перебігу реакцій підвищується під дією активаторів, і пригнічується під дією інгібіторів.
2. Класифікація та номенклатура ферментів, характеристика окремих класів
ферментів.
Номенклатура – тривіальна або систематична.
Систематична: хімічна назва субстрату, що каталізується,тип реакції, суфікс –аза. (ацилтрансфераза)
Тривіальна: хімічна назва субстрату + -аза, або загальноприйняті, історично установлені назви. (пепсин…)
Класифікація:
-
Оксидоредуктази. Кат.ок-відн реакції. Дегідрогенази,оксидази,цитохроми.
-
Трансферази. Міжмолекулярний перенос різних груп. Аміно-, метил-, ацил-, фосфо-, глікозилтрансферази, кінази(фосфорилюв. субстратів за рахунок фосф. залишку АТФ)
-
Гідролази. Каталізують реакції гідролізу (розщеплення субстратів за рахунок води). Естерази, пептидази, протеази, глікозидази.
-
Ліази. Каталізують реакції розщеплення ковалентних зв’язків між атомами С N O S негідролітичним шляхом. Декарбоксилази (відщеплюють від органічних кислот СО2), дегідратази (мінус Н2О, плюс =), альдолази (розщеплюють С-С зв. з утв. альдегідів).
-
Ізомерази. Реакції ізомеризації субстратів. Рацемази,епімерази.
-
Лігази. Реакції синтезу біомолекул за рахунок енергії АТФ.
3. Будова та механізми дії ферментів. Активний та алостеричний (регуляторний) центр.
Будова: прості,складні. Складні(холоферменти) мають небілкову частину. Прості скл тільки з білкової частини.
Білкова частина складного білка-ферменту називається апофермент(апоензим), небілкова-кофермент( коензим). Апофермент+кофермент=холофермент.
Активний центр – ділянка молекули ферментного білка, що взаємодіє з субстратом під час ферментативної реакції і необхідна для перетворення субстрату. Структура акт.ц : - ділянка що зв’язує субстрат, -каталітично активна ділянка (містить хімічні групи, які беруть участь в перетворенні субстрату).
Алостеричний центр – додатковий регуляторний центр, з яким взаємодіють алостеричні регулятори (ефектори,модулятори). Це такі ділянки молекули ферменту поза його активним центром, що здатні зв'язуватися слабкими типами зв’язків (означає – зворотньо) з тою або іншою речовиною (лігандом). Таке зв'язування приводить до такої конформаційної перебудови молекули ферменту, що поширюється і на активний центр, полегшуючи, або затрудняючи (сповільнюючи) його роботу. Відповідно такі речовини називаються алостеричними активаторами або алостеричними інгібіторами даного ферменту. Механізм дії: Ферменти збільшують швидкість реакції,яку каталізують . При відсутності ферменту практично ніякі реакції не відбуваються.
Процес ферментативного каталізу умовно можна розділити на три етапи:
1. приєднання молекули субстрату (S) до фермента (Е);
2. утворення проміжного фермент-субстратного комплексу та послідовне його перетворення на один або кілька перехідних (ЕS, ЕSх, ЕSхх) з подальшим утворенням нестабільного комплексу фермент-продукт (ЕР);
3. вивільнення продуктів реакції (Р) та фермента (Е).
Спочатку субстрат зближується з ферментом та орієнтується відносно його активного центра » зв’язування, утворення фермент-субстратного комплексу » комплекс перетворюється на один або декілька проміжних продуктів, послаблюються зв’язки в субстраті » відокремлюються продукти реакції.
4. Кофактори та коферменти. Будова та властивості коферментів, вітаміни як
попередники в біосинтезі коферментів.
Кофактори – низькомолекулярні небілкові сполуки, потрібні для реалізації ферментом своєї каталітичної активності. Це біоорганічні сполуки або іони металів. Вони можуть розглядатися як «допоміжні молекули/іони», які допомагають в біохімічних перетвореннях білка. Є органічні і неорганічні кофактори.
Органічні: Неорганічні:
Коферменти Іони металів
Простетичні групи
Коферменти(коензими) – біоорг сполуки небілкової природи, необхідні для дії ферменту, тобто перетворення субстрату в каталітичному розщепленні. Можуть сполучатись з апоферментом нековалентними або ковалентними звязками. Коферменти постійно споживаються і переробляються в процесі обміну речовин, одні ферменти зазвичай додають кофермент до ферментів, а інші усувають їх. Молекули коферментів часто є вітамінами або утворюються з них. Багато коферментів містять нуклеотиди як частину своїх структур, наприклад АТФ і НАД+
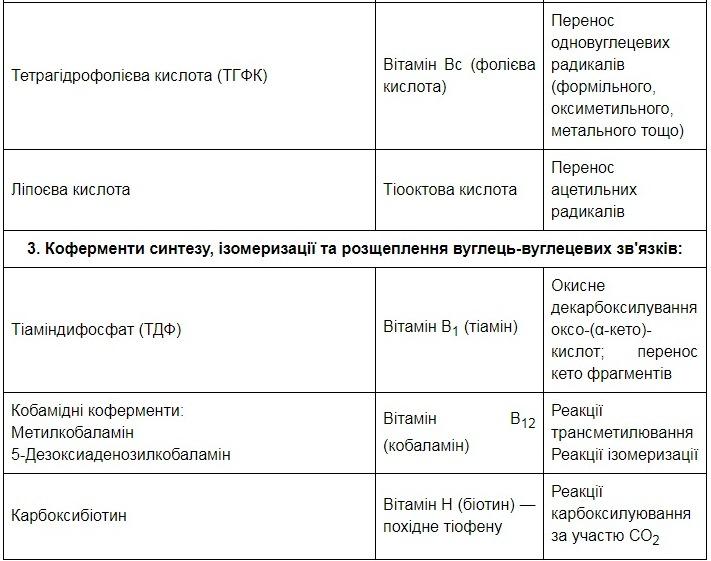
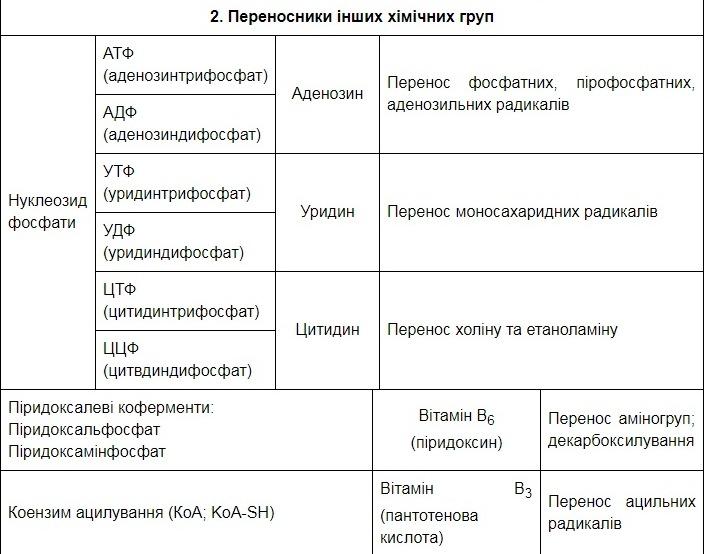
Коферменти-похідні вітамінів:
вітаміну В1, - тіаміндифосфат;
вітаміну В2 - флавінмононуклеотид (ФМН);
вітаміну В6 - піридоксальфосфат, піридоксамінфосфат;
пантотенової кислоти - коензим А;
вітаміну В12 - метилкобаламін, дезоксиадено-
зилкобаламін;
вітаміну Н (біотину) - карбоксибіотин;
фолієвої кислоти - тетрагідрофолієва кислота;
динуклеотиди (похідні нікотинаміду - НАД, НАДФ; похідна рибофлавіну - ФАД);
нуклеотиди - похідні пуринів та піримідинів (АТФ, АДФ, ЦТФ, ЦДФ, УТФ, УДФ);
комплекси порфіринів з іонами металів.
5. Коферменти: типи реакцій, які каталізують окремі класи коферментів.


6. Ізоферменти, особливості будови та функціонування, значення в
діагностиці захворювань.
Ізоферменти – множинні молекулярні форми одного й того ж ферменту. Каталізують одну й ту ж саму бх реакцію, але відрізняються за фіз-хім і каталітичними властивостями. Різні ізоферменти одного фермнету можуть бути присутніми в різних органах і тканинах.
Прикладом можуть бути ізоферменти лактатдегідрогенази (ЛДГ) - ферменту, що каталізує оборотну реакцію перетворення піровиноградної кислоти в молочну. За своєю молекулярною будовою ЛДГ є тетрамером, що побудований із протомерів двох типів: Н (серцевого - heart, англ.) та М (м'язового - muscle). В організмі людини присутні п'ять комбінацій зазначених протомерів, які створюють різні ізоферменти ЛДГ: ЛДГ1 (Н4), ЛДГ2 (Н3М1), ЛДГ3(Н2М2), ЛДГ4 (Н1М3) та ЛДГ5 (М4). Вони розподілені переважно в різних органах (міокарді, печінці, скелетних м'язах, нирках тощо). Ці ізоферменти розрізняються за своєю електрофоретичною рухомістю і їх визначення в плазмі крові має діагностичне значення для виявлення пошкоджень мембранних структур клітин, що спостерігаються при різних захворюваннях. Зокрема, при інфаркті міокарда збільшується концентрація в плазмі ізоферменту ЛДГ1, а при інфекційному та токсичному гепатиті - ізоформ ЛДГ4 та ЛДГ5, характерних для клітин печінки.
