
- •I Химическая термодинамика
- •1. Внутренняя энергия системы. Теплота и работа. Первое начало термодинамики. Закон Гесса. Тепловой эффект реакции.
- •2. Тепловые эффекты реакции. Зависимость cp от t. Зависимость δh от t. Уравнение Киргофа,анализ.
- •3. Второе начало термодинамики. Обратимые и необратимые процессы. Энтропия
- •2 Начало термодинамики.
- •Расчет изменения энтропии для различных процессов
- •4. Вычисление абсолютной энтропии. Постулат Планка
- •1.5.1 Расчет абсолютной энтропии
- •5.Равновесные и обратимые процессы. Изохорно-изотермический потернциал
- •6. Изобарно-изотермический потенциал
- •9. Зависимость константы равновесия от температуры.
- •8.Химическое равновесие .Константы.
- •10. Расчет константы химического равновесия через изобарный потенциал.
- •Законы Рауля
- •16.Вычисление массы паровой и жидкой фазы. Связь между составом жидкой и паровой фаз
- •17. Азеотропные растворы
- •18. Фракционная перегонка
- •19. Ограниченная взаимная растворимость жидкостей
- •21. Повышение температуры кипения (эбулиоскопия). Понижение(криоскопия)
- •23. Удельная электропроводность. Ее зависимость от концентрации электролита
- •24 Эквивалентная электропроводность
- •26 Кондуктометрическое титрование
- •27. Электродные потенциалы. Стандартный водородный электрод
- •[Править]Устройство
- •28 . Уравнение Нернста для электродного потенциала Вывод уравнения Нернста
- •29. Классификация электродов . Электроды 1го рода
- •30. Электроды 2го рода.
- •31. ОкИслительно-восстановительные электроды. Хингидронный электрод
- •32. Гальванический элемент. Элемент даниэля-якоби
- •Характеристики гальванических элементов
- •Применение
- •Гальванический элемент Даниэля-Якоби
- •33 Концентрационный элемент
- •34. Определение рН разными цепями
- •35 Электрохимическая коррозия
- •36. Основные понятия химической кинетики. Порядок и молекулярность реакций
- •2.1.11 Кинетика двусторонних (обратимых) реакций
- •40. Скорость химических реакции.Катализ.
1.5.1 Расчет абсолютной энтропии
Рассчитаем изменение энтропии некоторой системы при нагревании её от абсолютного нуля до температуры T при постоянном давлении. Из первого и второго начал термодинамики имеем:
![]() (I.61)
(I.61)
![]() (I.62)
(I.62)
Отсюда:
![]() (I.63)
(I.63)
Учитывая, что ST=0 = 0, получим:
![]() (I.64)
(I.64)
При T = 0 любое вещество может находиться только в твердом состоянии. При нагревании вещества возможен его переход в жидкое и затем в газообразное состояние; для фазовых переходов, происходящих в изобарно-изотермических условиях, изменение энтропии равно приведенной теплоте фазового перехода:
![]() (I.65)
(I.65)
Таким образом, нагревание вещества без фазовых переходов сопровождается непрерывным ростом энтропии; при фазовом переходе происходит скачкообразное изменение энтропии. Графическая зависимость энтропии вещества от температуры приведена на рисунке 1.3.
Учитывая это, рассчитать абсолютную энтропию любого вещества при любой температуре можно следующим образом:
![]() (I.66)
(I.66)
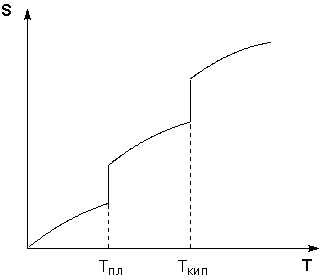
Рис. 1.3 Зависимость энтропии вещества от температуры.
Поскольку энтропия есть функция состояния, изменение энтропии в ходе химического процесса определяется только видом и состоянием исходных веществ и продуктов реакции и не зависит от пути реакции; оно может быть рассчитано по уравнению (I.67):
![]() (I.67)
(I.67)
Для многих веществ величины абсолютной энтропии в стандартных условиях приведены в справочной литературе.
Третий закон термодинамики (постулат Планка)
В 1911
г. Макс Планк [
![]() ]
предложил следующий постулат: энтропия
правильно сформированного кристалла
чистого вещества при абсолютном нуле
равна нулю .
Этот постулат может быть объяснен статистической
термодинамикой ,
согласно которой энтропия есть мера
беспорядочности системы на микроуровне
[
].
Соотношение
S = kblnW
часто
называют “уравнением Больцмана“, хотя
оно выведено М.Планком в 1900 г. [ 3].
В нем W – число различных состояний
системы, доступное ей при данных условиях,
или термодинамическая вероятность
макросостояния системы.
]
предложил следующий постулат: энтропия
правильно сформированного кристалла
чистого вещества при абсолютном нуле
равна нулю .
Этот постулат может быть объяснен статистической
термодинамикой ,
согласно которой энтропия есть мера
беспорядочности системы на микроуровне
[
].
Соотношение
S = kblnW
часто
называют “уравнением Больцмана“, хотя
оно выведено М.Планком в 1900 г. [ 3].
В нем W – число различных состояний
системы, доступное ей при данных условиях,
или термодинамическая вероятность
макросостояния системы.
kb = R/NA = 1,38.10-16 эрг/град – постоянная Больцмана В 1872 г. Л.Больцман [ ] предложил статистическую формулировку второго закона термодинамики [ ]: изолированная система эволюционирует преимущественно в направлении большей термодинамической вероятности [ 4].
Следует всегда помнить, что второй закон термодинамики не является абсолютным ; он теряет смысл для систем, содержащих малое число частиц, и для систем космического масштаба [ 5]. Второй закон, особенно в статистической формулировке, неприменим к живым объектам , которые представляют собой открытые системы и постоянно уменьшают собственную энтропию, создавая идеально упорядоченные молекулы, например, за счет энергии солнечного света [ ].
Для живых систем характерна самоорганизация, которую чилийский нейробиолог Умберто Матурана (Humberto Maturana) [ ] назвал в 1970 г. автопоэз (самосозидание). Живые системы не только сами постоянно удаляются от классического термодинамического равновесия, но и делают неравновесной окружающую среду. Еще в 1965 г. американский специалист по химии атмосферы Джеймс Лавлок (Lovelock) предложил в качестве критерия наличия жизни на Марсе оценивать равновесность состава атмосферы [ 6].
В атмосфере Земли содержатся одновременно кислород (21% по объему), метан (0,00018%), водород (0,00005%), моноксид углерода (0,00001%) – это явно неравновесная смесь при температурах -500 - +400С [ 7] [ ]. Земная атмосфера – открытая система, в формировании которой постоянно участвуют живые организмы.
В атмосфере Марса преобладает углекислый газ (95% - ср. с 0,035% на Земле), кислорода в ней менее 1%, а газы-восстановители (метан) пока не обнаружены [ 8] [ ]. Следовательно, атмосфера Марса практически равновесна – все реакции между содержащимися в ней газами уже осуществились. Из этих данных Лавлок заключил, что в настоящее время на Марсе жизни нет. В то же время существует возможность применять законы классической термодинамики к живым объектам. Открытые живые системы на определенных временах можно рассматривать какквазизакрытые по отношению к процессам, для которых быстро устанавливаются локальные равновесия (Гладышев Г.П. [ 9]). Структуры высшей иерархии образуют для более низших “термостат”, в рамках которого процессы можно считать квазиравновесными.
Однако вернемся к “нормальным” химическим системам. Введение энтропии дало возможность установить критерии, позволяющие определить направление и глубину протекания любого химического процесса (для большого числа частиц в равновесии). Макроскопические системы достигают равновесия , когда изменение энергии компенсируется энтропийной составляющей:
При
постоянном объеме и температуре:
Uv =
T
Sv или
(U-TS)
F
= 0
F
– энергия Гельмгольца [ 10]
[
]
или изохорно-изотермический потенциал
.При постоянном давлении и температуре:
Hp =
T
S p или
(H-TS) ![]() G
= 0
G
энергия Гиббса или
свободная энергия Гиббса или
изобарно-изотермический потенциал
G
= 0
G
энергия Гиббса или
свободная энергия Гиббса или
изобарно-изотермический потенциал
Изменение энергии Гиббса как критерий возможности химической реакции
Для данной температуры G = H - T S
При G < 0 |
реакция возможна; |
при G > 0 |
реакция невозможна; |
при G = 0 |
система находится в равновесии. |
Возможность самопроизвольной реакции в изолированной системе определяется сочетанием знаков энергетического (энтальпийного) и энтропийного факторов:
Знак H |
Знак S |
Возможность самопроизвольной реакции |
+ |
– |
Нет |
– |
+ |
Да |
– |
– |
Зависит от соотношения H и T S |
+ |
+ |
Зависит от соотношения H и T S |
Имеются обширные табличные данные по стандартным значениям Go и So (для энтропии по третьему закону есть нулевой уровень отсчета и соответственно абсолютные значения), позволяющие вычислить Go реакции. В случае, если температура отличается от 298 К и концентрации реагентов C – от 1 М, для процесса в общем виде:
aA +
bB ![]() xX
+ yY
xX
+ yY
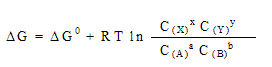
В положении равновесия G = 0 и Go = -RTlnK p , где Kp - константа равновесия
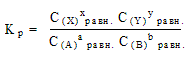
Иногда выражение для константы равновесия называют законом действующих масс (К.М.Гульдберг [ ], П.Вааге [ ] , 1867 г. ), поскольку в 1867 г. концентрации в работах норвежских ученых назывались “действующими массами”. Применительно к равновесию это не совсем верно [ ] [ (глава 4.7)], поскольку выражение для константы равновесия в большинстве случаев нельзя рассматривать как отношение кинетических уравнений прямой и обратной реакций (см. ниже).
Константа равновесия связана, таким образом, с энергией Гиббса: Kp = exp(- G =o/RT)
