
- •I Химическая термодинамика
- •1. Внутренняя энергия системы. Теплота и работа. Первое начало термодинамики. Закон Гесса. Тепловой эффект реакции.
- •2. Тепловые эффекты реакции. Зависимость cp от t. Зависимость δh от t. Уравнение Киргофа,анализ.
- •3. Второе начало термодинамики. Обратимые и необратимые процессы. Энтропия
- •2 Начало термодинамики.
- •Расчет изменения энтропии для различных процессов
- •4. Вычисление абсолютной энтропии. Постулат Планка
- •1.5.1 Расчет абсолютной энтропии
- •5.Равновесные и обратимые процессы. Изохорно-изотермический потернциал
- •6. Изобарно-изотермический потенциал
- •9. Зависимость константы равновесия от температуры.
- •8.Химическое равновесие .Константы.
- •10. Расчет константы химического равновесия через изобарный потенциал.
- •Законы Рауля
- •16.Вычисление массы паровой и жидкой фазы. Связь между составом жидкой и паровой фаз
- •17. Азеотропные растворы
- •18. Фракционная перегонка
- •19. Ограниченная взаимная растворимость жидкостей
- •21. Повышение температуры кипения (эбулиоскопия). Понижение(криоскопия)
- •23. Удельная электропроводность. Ее зависимость от концентрации электролита
- •24 Эквивалентная электропроводность
- •26 Кондуктометрическое титрование
- •27. Электродные потенциалы. Стандартный водородный электрод
- •[Править]Устройство
- •28 . Уравнение Нернста для электродного потенциала Вывод уравнения Нернста
- •29. Классификация электродов . Электроды 1го рода
- •30. Электроды 2го рода.
- •31. ОкИслительно-восстановительные электроды. Хингидронный электрод
- •32. Гальванический элемент. Элемент даниэля-якоби
- •Характеристики гальванических элементов
- •Применение
- •Гальванический элемент Даниэля-Якоби
- •33 Концентрационный элемент
- •34. Определение рН разными цепями
- •35 Электрохимическая коррозия
- •36. Основные понятия химической кинетики. Порядок и молекулярность реакций
- •2.1.11 Кинетика двусторонних (обратимых) реакций
- •40. Скорость химических реакции.Катализ.
3. Второе начало термодинамики. Обратимые и необратимые процессы. Энтропия
2 Начало термодинамики.
Содержание второго начала термодинамики.
Первого начала термодинамики недостаточно для полной характеристики термодинамических процессов. В рамках первого начала можно установить энергетический баланс процессов, но получить сведения о возможности, направлении и пределах их протекания не представляется возможным.
Итак, второе начало позволяет:
находить направление и устанавливать возможность самопроизвольного (естественного, спонтанного) течения термодинамических процессов и пределы их протекания;
определять условия, при которых превращение какого-либо запаса энергии в полезную работу происходит наиболее полно.
Обратимые и необратимые процессы.
Подобно тому, как в первом начале термодинамики вводится функция состояния – внутренняя энергия, во втором начале – функция состояния, получившая название энтропия (S) (от греческого entropia – поворот, превращение). Рассмотрение изменения этой функции привело к разделению всех процессов на две группы: обратимые и необратимые (самопроизвольные) процессы.
Процесс называется обратимым, если его можно провести сначала в прямом, а затем в обратном направлении и так, что ни в системе, ни в окружающей среде не останется никаких изменений. Полностью обратимый процесс – абстракция, но многие процессы можно вести в таких условиях, чтобы их отклонение от обратимости было весьма мало. Для этого необходи-
мо, чтобы в каждой своей бесконечно малой стадии состояние системы, в которой этот процесс происходит, отвечало бы состоянию равновесия.
Состояние равновесия – особое состояние термодинамической системы, в которое она переходит в результате обратимого или необратимого процессов и может оставаться в нем бесконечно долго. Реальные процессы могут приближаться к обратимым, но для этого они должны совершаться медленно.
Процесс называется необратимым (естественным, спонтанным, самопроизвольным), если он сопровождается рассеянием энергии, т. е. равномерным распределением между всеми телами системы в результате процесса теплопередачи.
В качестве примеров необратимых процессов могут быть названы следующие:
замерзание переохлажденной жидкости;
расширение газа в вакуумированное пространство;
диффузия в газовой фазе или в жидкости.
Систему, в которой произошел необратимый процесс, можно возвратить в исходное состояние, но для этого над системой нужно совершить работу.
К необратимым процессам относится большинство реальных процессов, так как они всегда сопровождаются работой против сил трения, в результате чего происходят бесполезные энергозатраты, сопровождающиеся рассеянием энергии.
Для иллюстрации понятий рассмотрим идеальный газ, находящийся в цилиндре под поршнем. Пусть начальное давление газа Р1 при его объеме V1 (рис. 4.1).

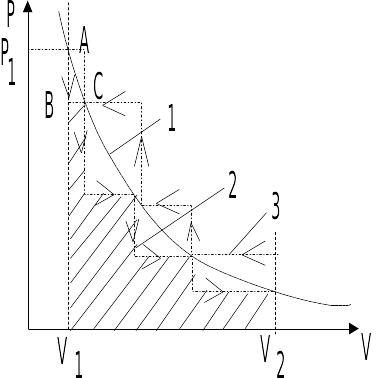
Если с поршня снять некоторое количество песка, то давление газа над поршнем резко снизится (от А до В) лишь после чего произойдет увеличение объема газа до равновесной величины (от В до С). Характер этого процесса – ломанная линия 2. Эта линия характеризует зависимость P=f (V) при необратимом процессе.
Рис. 4.1. Зависимость
давления газа от его объема при обратимом
(1) и необратимом процессах (2, 3).
Таким образом, любой термодинамический процесс характеризуется максимально возможной величиной работы, если он совершается в обратимом режиме. К аналогичному выводу можно прийти, если рассмотреть процесс сжатия газа. Только следует иметь ввиду, что в этом случае величина работы – отрицательная величина (рис. 4.1, ломаная 3).
Энтропия.
Термодинамическая энтропия — аддитивная термодинамическая величина, функция состояния термодинамической системы.
Энтропия, функция
состояния S термодинамической системы,
изменение которой dS для бесконечно
малого обратимого изменения состояния
системы равно отношению количества
теплоты
![]() полученного
системой в этом процессе (или отнятого
от системы), к абсолютной температуре
полученного
системой в этом процессе (или отнятого
от системы), к абсолютной температуре
![]()
Величина dS является
полным дифференциалом, т.е. ее интегрирование
по любому произвольно выбранному пути
дает разность между значениями энтропии
в начальном (А) и конечном (В) состояниях:
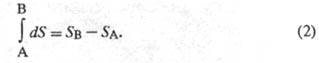
Теплота не является
функцией состояния, поэтому интеграл
от δQ зависит от выбранного пути перехода
между состояниями А и В. Энтропия
измеряется в Дж/(моль·град).
![]() где
р - давление, μi - химический потенциал
i-го компонента.
где
р - давление, μi - химический потенциал
i-го компонента.
Простые формулы
связывают энтропию с теплоемкостями
при постоянном давлении Ср и постоянном
объеме Cv:
![]() С
помощью энтропии формулируются условия
достижения термодинамического равновесия
системы при постоянстве ее внутренней
энергии, объема и числа молей i-го
компонента (изолированная система) и
условие устойчивости такого равновесия:
С
помощью энтропии формулируются условия
достижения термодинамического равновесия
системы при постоянстве ее внутренней
энергии, объема и числа молей i-го
компонента (изолированная система) и
условие устойчивости такого равновесия:
![]() Это
означает, что энтропия изолированной
системы достигает максимума в состоянии
термодинамического равновесия.
Самопроизвольные процессы в системе
могут протекать только в направлении
возрастания энтропии.
Это
означает, что энтропия изолированной
системы достигает максимума в состоянии
термодинамического равновесия.
Самопроизвольные процессы в системе
могут протекать только в направлении
возрастания энтропии.
Для изолированных систем второй закон утверждает: dS і 0, (4.2) т.е. энтропия изолированных систем в необратимых процессах может только возрастать, а в состоянии термодинамического равновесия она достигает максимума (dS = 0,
d 2S < 0).
При любых процессах, протекающих в термодинамических изолированных системах, энтропия либо остается неизменной, либо увеличивается. Таким образом, энтропия указывает направление самопроизвольно протекающих процессов. Рост энтропии указывает на приближение системы к состоянию термодинамического равновесия. В состоянии равновесия энтропия принимает максимальное значение. Закон возрастания энтропии можно принять в качестве еще одной формулировки второго закона термодинамики.
